Regenerative Medizin: Bauanleitung für ein Herz
Doris Taylor nimmt es niemanden krumm, wenn man sie als Dr. Frankenstein bezeichnet. "Ich finde, das ist sogar ein recht großes Kompliment", gesteht sie. Es zeigt, dass ihre Forschungsarbeit die Grenzen des Möglichen verschiebt: Als Direktorin für regenerative Medizin am Texas Heart Institute in Houston entnimmt sie regelmäßig Organe wie Herz und Lunge von frisch Verstorbenen und baut sie von den Zellen angefangen neu auf - in der Hoffnung, sie eines Tages im Patienten wieder zum Leben zu erwecken. So abwegig ist der Vergleich mit der Romanfigur also nicht.
Die Wissenschaftlerin zählt zur Avantgarde eines Forschungszweigs, dessen Ziel es ist, Transplantationen ohne Risiko einer Abstoßung durchzuführen. In der Theorie klappt das ganz einfach: Man nehme das Organ eines Toten (oder eines Tiers passender Größe), entferne alle alten Zellen und bevölkere das verbleibende Proteingerüst mit Stammzellen, die immunologisch zum Empfänger passen. Voilà, der weltweite Mangel an transplantierbaren Organen ist behoben.
In der Praxis steht dem allerdings eine Anzahl schier unüberwindlicher Schwierigkeiten entgegen. Forscher konnten zwar bereits erfolgreich relativ einfach aufgebaute Hohlorgane wie Luftröhre und Blase züchten und verpflanzen, doch um eine Niere oder eine Lunge heranzuziehen, müssen Dutzende von unterschiedlichen Zelltypen an genau die richtige Stellen bugsiert werden und ganze Blutgefäßnetze zu ihrer Versorgung entstehen. Überdies muss das neue Gewebe nicht nur steril sein und mitwachsen können, falls der Patient noch jung ist, es sollte auch zumindest grundsätzlich zur Selbstreparatur im Stande sein.
Vor allem aber muss ein Zuchtorgan funktionieren - und das am besten ein Leben lang. Das Herz ist nach der Niere und der Leber das am dritthäufigsten benötigte Organ, allein in den USA umfasst die Warteliste etwa 3500 Patienten. Gleichzeitig stellt es ganz spezielle Herausforderungen an die Transplantation und das "Bioengineering": Es muss täglich rund 7000 Liter Blut durch den Körper pumpen - ohne dass es ein Ersatzsystem für den Notfall gäbe. Es hat Kammern und Klappen, die aus unterschiedlichen Arten spezialisierter Muskelzellen, so genannten Kardiomyozyten, aufgebaut sind. Und Spenderherzen sind Mangelware, weil die Organe frisch Verstorbener häufig durch Krankheit oder Wiederbelebungsversuche beschädigt sind. Eine stete Versorgung mit Ersatzorganen wäre also mehr als nur wünschenswert.
Die ultimative Herausforderung
Es ist die ultimative Herausforderung für die Bioingenieure. Doch Taylor, die einige der ersten erfolgreichen Versuche zur Zucht von Rattenherzen leitete [1], ist zuversichtlich. "Ich halte das im Grund für sehr gut machbar", sagt sie. Und fügt dann schnell hinzu: "Was nicht heißt, dass es einfach ist."
Einige ihrer Kollegen sind weniger optimistisch. Paolo Macchiarini, Thoraxchirurg am Karolinska Institut in Stockholm, hat bereits mehrfach rekonstruierte Luftröhren verpflanzt, bezweifelt aber, dass das auch mit komplexeren Organen klappt. Für den Ersatz röhrenartiger Strukturen wie Luftröhren, Arterien und Speiseröhren könnte die Methode allerdings bald zur Routine werden.
Doch selbst wenn Taylors Verfahren nicht von Erfolg gekrönt wird, lohne sich die Mühe, findet jedenfalls Alejandro Soto-Gutiérrez, Forscher und Chirurg an der University of Pittsburgh in Pennsylvania: "Ein Traum wäre es, damit Organe für die Transplantation herzustellen. Aber auch abgesehen davon können wir eine Menge lernen." Wie organisieren sich die Zellen im Herzen? Wie behandelt man beschädigte oder kranke Organe?
Schwieriger Gerüstbau
Seit mehr als einem Jahrzehnt können Biologen embryonale Stammzellen in schlagende Herzmuskelzellen verwandeln. Mit Hilfe eines elektrischen Schrittmachers finden sie sogar in einen gemeinsamen Takt, den sie über Stunden aufrechterhalten. Doch um von zuckenden Zellen in der Petrischale zu einem funktionierenden Organ zu gelangen, ist ein so genanntes Scaffold, ein Gerüst, vonnöten, das die Zellen in drei Dimensionen anordnet.
Möglicherweise können die Forscher solche Strukturen irgendwann durch dreidimensionales Drucken kreieren, wie Anfang des Jahres an einer künstlichen Luftröhre demonstriert [2]. Doch auf absehbare Zeit übersteigt die Struktur des menschlichen Herzens bei Weitem die Fähigkeiten selbst ausgefeilter Maschinen. Das gilt besonders für die feinen Verästelungen der Kapillaren, die das Herz mit Sauerstoff und Nährstoffen versorgen und für den Abtransport des Abfalls zuständig sind. Diese Vaskularisierung, also die Blutversorgung, "ist das größte Hindernis", sagt Anthony Atala, Urologe an der Wake Forest University in Winston-Salem. Der Forscher verpflanzt selbst gezüchtete Blasen in Patienten [3] und will die Technik nun auch auf Nieren ausdehnen.
Der neueste und aussichtsreichste Ansatz der Herzbaumeister besteht deshalb darin, das wiederzuverwenden, was die Biologie bereits zur Verfügung stellt. Wie das funktioniert, kann man im Bostoner Massachusetts General Hospital verfolgen. Hier präsentiert Harald Ott, Chirurg und Forscher im Bereich regenerative Medizin, eine Methode, die er Mitte der 2000er Jahre während seiner Ausbildung bei Doris Taylor entwickelte.
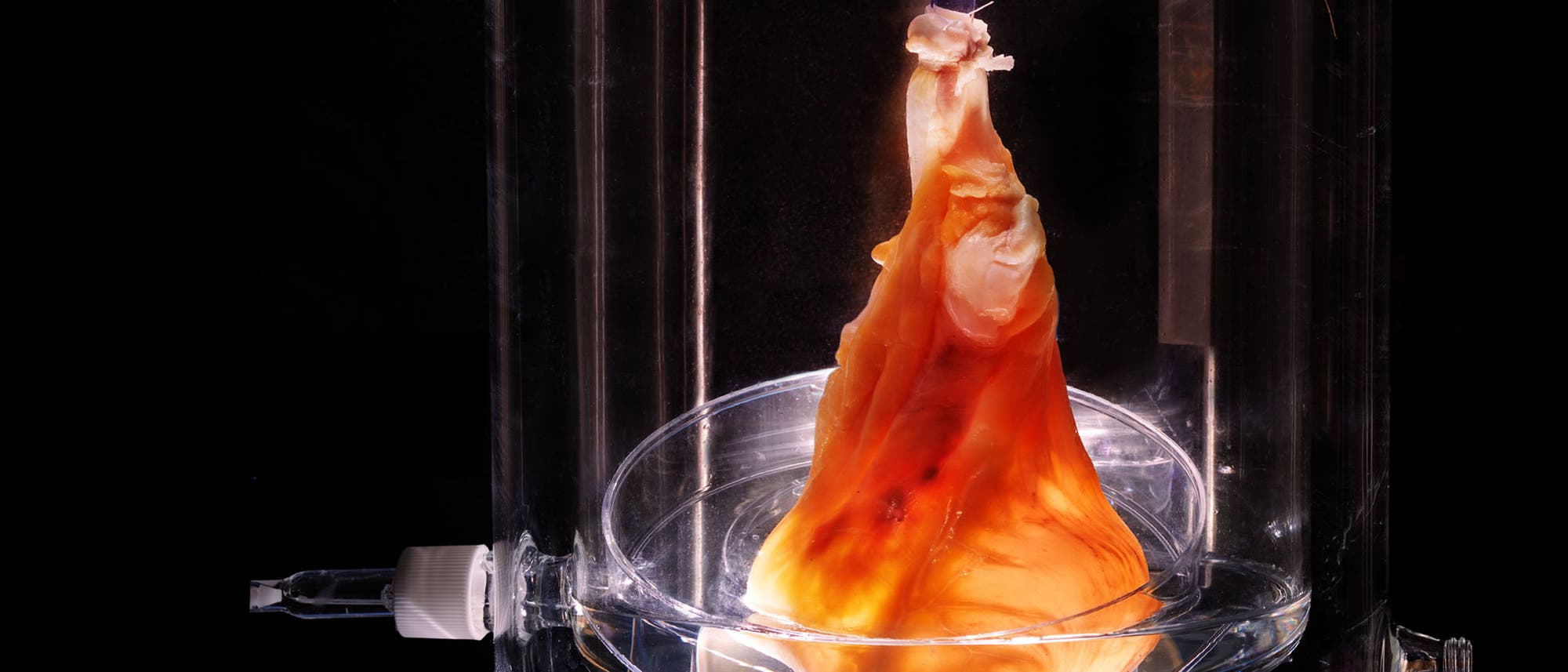
In einer zylinderförmigen Kammer aus Glas und Kunststoff hängt ein frisches Menschenherz an Plastikschläuchen, eine Pumpe drückt leise Spüllösung durch einen Schlauch in die Aorta. Die Strömung schließt die Aortenklappe und lässt die Lösung durch das Netz aus feinen Blutgefäßen laufen, über das noch wenige Tage zuvor der lebende Muskel versorgt wurde. Im Verlauf einer Woche, so erklärt Ott, entfernt diese Spülung sämtliche Lipide, DNA, lösliche Proteine, Zucker und fast das gesamte restliche zelluläre Material aus dem Herzen. Übrig bleibt ein farbloses Netz aus Strukturproteinen wie Kollagen und Laminin: die so genannte extrazelluläre Matrix, die das Organ zusammenhält. Sie liefert schließlich die Basis für das neue Herz.
Präzises Spülen
Im Grund muss sie nicht einmal von Menschen stammen: Besonders viel versprechend sind Schweineherzen, denn die Tiere haben alle wichtigen Komponenten der extrazellulären Matrix, tragen aber höchstwahrscheinlich keine menschlichen Krankheiten. Auch das Problem gescheiterter Wiederbelebungsversuche oder krankheitsgeschwächter Herzmuskulatur stellt sich bei ihnen nicht. "Schweinegewebe ist viel sicherer als das von Menschen, und es ist praktisch unbegrenzt zu haben", sagt Stephen Badylak, Forscher für regenerative Medizin an der University of Pittsburgh.
Der schwierige Part, erklärt Ott, sei sicherzustellen, dass die Lösung genau die richtige Menge an Material auflöst. Spült man zu wenig heraus, behält die Matrix einen Rest der Zelloberflächenmoleküle, die eine Abstoßung durch das Immunsystems ablösen können. Entfernt man zu viel, gehen vielleicht wichtige Proteine und Wachstumsfaktoren verloren, die den neu eingebrachten Zellen vorschreiben, wo sie sich ansiedeln und wie sie sich verhalten sollen. "Wenn man eine mildere Substanz verwendet und den Spülzeitraum kurz hält, bekommt man ein besseres Rekonstruktionsergebnis", erläutert Thomas Gilbert, der die Dezellularisierung bei ACell untersucht, einem Unternehmen in Columbia, Maryland, das Produkte aus extrazellulärer Matrix für die regenerative Medizin anfertigt.
Durch Versuch und Irrtum bei der Feinabstimmung von Konzentration, Timing und Druck der Waschlösung haben die Forscher inzwischen an hunderten Organen den Prozess der Dezellularisierung immer weiter verfeinert. Er gilt als der am weitesten entwickelte Schritt bei der Organherstellung. Leider ist er bloß der erste von vielen: Denn nun muss das Gerüst mit menschlichen Zellen wiederbesiedelt werden.
Anfang der Wiederbesiedlung
Diese Rezellularisierung bringt ebenfalls einiges an Problemen mit sich: "Erstens: Welche Zellen verwendet man? Zweitens: Wie viele Zellen verwendet man? Und drittens: Sollen es ausgereifte Zellen, embryonale Stammzellen oder iPS-Zellen sein? Woher nimmt man die Zellen am besten?", fragt Jason Wertheim, Chirurg an der Feinberg School of Medicine der Northwestern University in Chicago.
Erwachsene Zellen zu benutzen, sei schwierig - gelinde gesagt, meint Taylor: "Man kann adulte Kardiozyten nicht dazu bringen, sich zu teilen", erklärt sie. "Könnte man das, würden wir dieses Gespräch überhaupt nicht führen." Dann könnten sich beschädigte Herzen nämlich selbst reparieren, und man bräuchte keine Transplantate.
Die meisten Wissenschaftler im Feld verwenden daher eine Mischung aus zwei oder mehr Zelltypen - zum Beispiel endotheliale Vorläuferzellen, um Blutgefäße auszukleiden, und Vorstufen von Muskelzellen, um die Wände der Kammern zu züchten. Ott hat diese Zellen aus induzierten pluripotenten Stammzellen (iPS-Zellen) generiert - adulte Zellen, die mit Hilfe von Wachstumsfaktoren auf ein Stadium reprogrammiert wurden, das embryonalen Stammzellen ähnelt. iPS-Zellen können von Patienten, die eine Spende benötigen, entnommen werden, um daraus immunologisch übereinstimmende Gewebe zu entwickeln.
Grundsätzlich könnte man mit Hilfe der iPS-Zell-Strategie dem Herz eine komplette Ausstattung an Zelltypen mitgeben - darunter Gefäßzellen und verschiedene Sorten von Herzmuskelzellen. Doch in der Praxis ergeben sich wieder ganz eigene Probleme. Eins davon ist die schiere Größe des menschlichen Herzens. Die Zahlen werden laut Ott erheblich unterschätzt. "Eine Million Zellen heranzuziehen ist eine Sache, 100 Millionen oder 50 Milliarden eine ganz andere." Darüber hinaus wissen die Forscher nicht, ob sich auch die richtigen Zelltypen ausbilden, wenn sie mit iPS-Zellen die embryonale Entwicklung in einem erwachsenen Herzgerüst nachbilden.
Spürsinn für die Umgebung
Sobald sie das Gerüst aus extrazellulärer Matrix kolonisieren, setzen sich einige der unreifen Zellen fest und fangen an, sich zu teilen. Um sie aber zu funktionstüchtigen und schlagenden Kardiomyozyten zu machen, braucht es mehr als nur sauerstoffreiches Medium und Wachstumsfaktoren. "Zellen nehmen ihre Umgebung wahr", erklärt Angela Panoskaltsis-Mortari, die an der University of Minnesota in Minneapolis an transplantierbaren Lungen arbeitet. "Sie erkennen nicht nur Substanzen, sondern auch die Steifheit des Gewebes und mechanische Belastungen." Solche Faktoren drängen die Zellen ebenfalls in die richtige Entwicklungslaufbahn.
Die Wissenschaftler müssen das Herz also in einen Bioreaktor setzen, der einen Herzschlag nachahmt. Otts Apparatur erreicht das durch eine Kombination aus einer Art Schrittmacher, dessen elektrische Signale das Zucken der Kardiomyozyten synchronisiert, und mechanischen Schlagbewegungen, die durch eine Pumpe hervorgerufen werden. Doch für die Wissenschaftler ist es ein ständiger Kampf, die Bedingungen im menschlichen Körper zu kopieren - beispielsweise Veränderungen des Herzschlags und des Blutdrucks oder der Einfluss von Medikamenten. "Der Körper reagiert prompt und ändert die Bedingungen so schnell, dass es quasi unmöglich ist, das in einem Bioreaktor nachzubilden", so Badylak.
Als Taylor und Ott die ersten Bioreaktoren für dezellularisierte und wiederbesiedelte Rattenherzen entwickelten, mussten sie permanent dazulernen. "Wir hatten überall Klebeband im Labor", erinnert sich Ott. Doch schließlich waren die Herzen nach acht bis zehn Tagen im Bioreaktor fähig, von allein zu schlagen und erreichten dabei etwa 2 Prozent der Pumpkapazität eines normalen erwachsenen Rattenherzens. Laut Taylor können sie inzwischen die Herzen von Ratten und sogar größeren Säugetieren dazu bringen, mit bis zu 25 Prozent der normalen Kapazität zu pumpen - wobei diese Ergebnisse allerdings noch unveröffentlicht sind. Taylor und Ott sind überzeugt, auf dem richtigen Weg zu sein.
Operation mit schlagendem Herzen
Die letzte Hürde ist gleichzeitig eine der höchsten: ein neu gezüchtetes, durch Bioengineering hergestelltes Herz in ein lebendiges Tier zu transplantieren und es dort für längere Zeit am Schlagen zu halten.
Das erste Hindernis ist dabei ein intaktes Gefäßsystem. Jede unbedeckte Stelle der Matrix kann der Entstehung von Gerinnseln Vorschub leisten - mit womöglich fatalen Folgen für Organ oder Tier. "Man muss schon ein ziemlich intaktes Endothel haben, das jedes Gefäß vollständig auskleidet, ansonsten bekommt man Gerinnung oder ein Leck", erläutert Gilbert.
"Wir stehen da, wo man mit Herztransplantationen vor Jahrzehnten war."Angela Panoskaltsis-Mortari
Trotzdem konnte Ott mittlerweile zeigen, dass solche rekonstruierten Organe eine Zeit lang überleben. Seine Arbeitsgruppe transplantierte eine einfache, nachgebildete Lunge in eine Ratte und beobachtete, dass diese den Gasaustausch des Tieres bewältigen konnte - allerdings füllte sich ihr Innenraum relativ schnell mit Flüssigkeit [4]. Eine Rattenniere, ein weiteres Zuchttransplantat, das Otts Gruppe dieses Jahr vorstellte, überlebte, ohne dass sich Blutgerinnsel bildeten. Dessen Fähigkeit zur Urinfiltration war allerdings nur minimal - vermutlich weil das Verfahren nicht genügend Zellen des entsprechenden Typus hervorgebracht hatte [5]. Außerdem verpflanzten Teams von Ott und anderen Forschern rekonstruierte Herzen in Ratten - meist in den Hals, den Bauchraum oder neben das eigene Herz des Tiers.
Doch obwohl die Forscher die Organe mit Blut versorgten und zeitweilig zum Schlagen brachten, schaffte es keines dieser Herzen, genügend Blut zu pumpen. Die Forscher müssen deshalb zuerst viel höhere Kapazitäten für solche Organe vorweisen, bevor sie sie in Tiere von mehr als nur Rattengröße einsetzen.
Es gibt eben keinen Raum für Fehler. Ein Herz, sagt Badylak, müsse funktionieren, sobald es an seinen Platz transplantiert wird. "Mit ein, zwei oder fünf Prozent der Auswurffraktion eines normalen Herzens kann man gar nichts ausrichten". Auch Panoskaltsis-Mortari räumt ein: "Wir machen momentan ganz kleine Schritte. Wir stehen da, wo man mit Herztransplantationen vor Jahrzehnten war."
In kleinerem Maßstab
Immerhin treibt die Dezellularisierungsmethode andernorts bereits Früchte: bei der Verbesserung gewebebasierter Ersatzeile beispielsweise. So könnte eine gezüchtete Herzklappe länger halten als eine aus Kunststoff oder totem Gewebe, weil sie das Potenzial hat, mit dem Patienten mitzuwachsen und sich selbst zu reparieren. Und auch andere Organe müssen vielleicht nicht immer komplett ersetzt werden. "Ich wäre überrascht, wenn man in den nächsten fünf bis sieben Jahren nicht auch Patienten sähe, denen mindestens der Teil einer Arterie, ein Lungenflügel oder ein Leberlappen implantiert wurde", glaubt Badylak.
Taylor vermutet, dass solche Ansätze Patienten mit schweren Herzdefekten wie dem hypoplastischen Linksherzsyndrom helfen könnten. Bei dieser Krankheit ist die eine Hälfte des Herzens stark unterentwickelt. Die Wiederherstellung "zwingt einen letztlich dazu, alles Nötige selbst zu züchten", erklärt die Forscherin.
Auch Therapien, bei denen Zellen ins Herz eingebracht werden, könnten profitieren. Zum Beispiel verstehen Wissenschaftler immer besser, wie sich Herzzellen in drei Dimensionen entwickeln. In Zukunft könnten neue Zellen mit Hilfe von partiellen Gerüsten aus synthetischen Materialien oder Spendergewebe dazu gebracht werden, beschädigte Bereiche neu zu besiedeln. Damit ließen sich Herzen wie mit einer Art Pflaster reparieren.
So frankensteinesk die Gläser mit den geisterhaft schwebenden Organen im Labor anmuten mögen, für Taylor geht es darum, einen Dienst an der Menschheit zu leisten. "Natürlich denke ich manchmal: 'Was habe ich mir da nur aufgehalst?' Aber wenn mich dann ein Kind anruft und fragt: 'Kannst du meiner Mutter helfen?', dann weiß ich, dass es die Mühe wert ist."
Dieser Artikel erschien unter dem Titel "How to build a heart" in Nature 499, S. 20-22, 2013.

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.