Materialforschung: Biomolekül als Elektronikbaustein
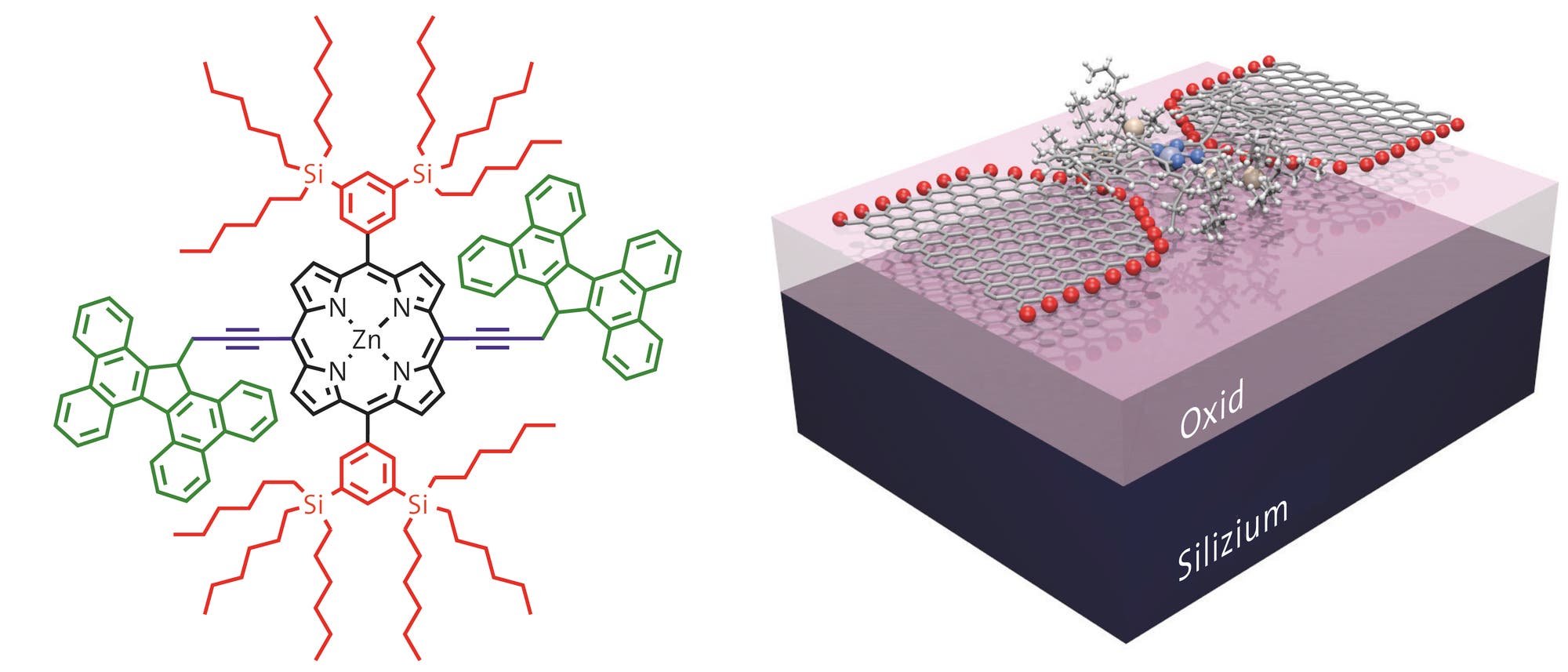
Wir Menschen brauchen sie zum Atmen und zur Entgiftung des Körpers, Pflanzen zum Einfangen von Licht bei der Fotosynthese und Bakterien sowohl für die Verwertung als auch die Erzeugung von Wasserstoff. Kurzum, Zellen der unterschiedlichsten Lebensformen nutzen Porphyrine für unzählige Funktionen. Die ringförmigen Moleküle bilden mit Eisen die Sauerstoff bindende Hämgruppe im roten Blutfarbstoff und mit Magnesium das für Pflanzen unentbehrliche Chlorophyll. Als Bestandteil der Enzyme aus der riesigen Familie der P450-Cytochrome sind sie außerdem an einer schier unüberschaubaren Vielzahl von chemischen Reaktionen beteiligt, unter anderem auch am Abbau von Schadstoffen in der Leber.
Dabei ist ihre Struktur recht kompliziert: Vier fünfgliedrige Ringe verbinden sich über jeweils ein Brückenkohlenstoffatom zu einem größeren Kranz, der als gigantischer Kreisverkehr für Elektronen dient. Während im Benzol sechs Elektronen rotieren, bringt es der Porphyrinring auf 18 und zählt damit ebenfalls zu den aromatischen Verbindungen, die sich durch besondere Stabilität auszeichnen. Jeder der vier Fünfringe enthält ein Stickstoffatom, das dem Innenraum des Kranzes zugewandt ist und dort als Andockstelle für Metallionen dienen kann, wie etwa Eisen im Häm oder Magnesium im Chlorophyll.
Trotz ihrer komplizierten Struktur sind diese Moleküle überraschend leicht herzustellen, und die Evolution fand sie offenbar außerordentlich nützlich. Doch anders als ihre noch komplizierteren künstlichen Verwandten, die Phthalocyaninfarbstoffe, haben sie bisher keine kommerzielle Anwendung gefunden. Zwei voneinander unabhängige Studien könnten jetzt dazu beitragen, dass sich das ändert. ...
Schreiben Sie uns!
Beitrag schreiben