Weltblutspendetag: Warum Blut immer noch alternativlos ist
112,5 Millionen Blutspenden verzeichnet die Weltgesundheitsorganisation jedes Jahr – und es sind viel zu wenig. Im September 2016 schlug das Rote Kreuz Alarm: In Deutschland würden Blutkonserven knapp, sogar medizinische Eingriffe seien verschoben worden. Auch anderswo herrscht Mangel. In Indien fehlen über eine Million Blutkonserven pro Jahr, in den USA schrumpften die Reserven auf unter fünf Tagesrationen.
Blutkonserven sind so begehrt, weil nur sie im Notfall die zentrale Funktion des Bluts aufrechterhalten: den Sauerstofftransport von der Lunge in die Gewebe. Diese eigentlich sehr simple Aufgabe könnte aber auch ein Ersatzstoff übernehmen, überlegten Fachleute schon in den 1960er Jahren. Besonders Militärs interessierten sich sehr für unbegrenzt lagerfähige Alternativen, die sich in großen Mengen erzeugen und auf Schlachtfeldern einfach einsetzen ließen. Interessant sind solche Ersatzstoffe jedoch ebenso für den Katastrophenschutz, und auch den normalen medizinischen Einsatz würde eine solche Substanz erleichtern.
Mut machte damals ein simples Experiment, in dem eine Flüssigkeit so viel Sauerstoff löste, dass eine Maus darin atmen konnte. Doch noch heute verlassen sich Krankenhäuser weltweit bei Bluttransfusionen ausschließlich auf Spenderblut. Der Grund: Es gibt trotz jahrzehntelanger Forschung keinen künstlichen Ersatzstoff, der die hohen Anforderungen erfüllt.
Warum braucht man einen Ersatz für Blut?
Mit dem derzeitigen Spendenaufkommen ist der große Bedarf nicht zu decken – die Zahl der Spender sinkt sogar tendenziell, besonders in den Industrieländern. Das britische Gesundheitssystem vermeldete 2015, dass es satte 40 Prozent weniger Neu-Spender registrierte als noch zehn Jahre zuvor. Nicht nur schwer verletzte Unfallopfer brauchen die Transfusionen, auch bei größeren chirurgischen Eingriffen kommt man oft nicht ohne Blutkonserven aus, genauso in der Krebstherapie bei Patienten, die kein neues Blut bilden.
Dabei sind Blutkonserven alles andere als optimal. Selbst sachgerecht gelagert halten sie maximal 42 Tage, dazu müssen sie allerdings gekühlt werden. Außerhalb der kontrollierten Bedingungen des Medizinbetriebs sind Blutkonserven damit kaum einsetzbar. Zudem altert das Blut auch bei korrekter Lagerung merklich – vor allem bindet es Sauerstoff immer stärker, weil der Signalstoff 2,3-Diphosphoglycerat (2,3-DPG), der bei der Freisetzung von Sauerstoff hilft, binnen etwa zwei Wochen aus dem Blut verschwindet. Das Spenderblut gibt nur ein Fünftel so viel Sauerstoff ans Gewebe ab wie normal – ein Effekt, der erst etwa 24 Stunden nach der Transfusion zurückgeht.
Aber auch die Sicherheit ist nach wie vor ein gewisses Problem. Obwohl Bluttests die Gefahr einer Infektion drastisch reduziert haben, besteht immer noch ein Risiko von etwa eins zu einer Million, sich bei einer Transfusion mit Hepatitis C oder HIV zu infizieren. Hinzu kommen unbekannte Erreger, die womöglich von Tests nicht erfasst werden, und exotische Bedrohungen wie Prionen – ob diese Eiweiße sich über Spenderblut verbreiten können, ist derzeit offen. Zusätzlich gibt es bei etwa einer von 30 Transfusionen milde Abstoßungsreaktionen wie Fieber oder Unwohlsein.
Welche Anforderungen muss ein Blutersatz erfüllen?
Trotz dieser Nachteile ist Blut bisher das unerreichte Vorbild für jeden Ersatzstoff. Hoch sind die Anforderungen, die man an einen künstlichen Ersatz stellt. Der Stoff sollte möglichst wenig, idealerweise überhaupt keine anderen Auswirkungen auf den Organismus haben und möglichst langsam aus dem Blut verschwinden. Vor allem aber liegt das Augenmerk auf Sauerstoffaufnahme und -abgabe.
Der Sauerstoffträger muss das Gas sehr stark binden, um es während der kurzen Lungenpassage effektiv aufzunehmen. Andererseits darf die Bindung auch nicht so stark sein, dass der Sauerstoff im Gewebe nicht wieder abgegeben wird – potenziell ein Widerspruch. Ein Ersatzstoff soll beide Anforderungen vereinen, auf welche Weise, ist jedoch noch nicht klar. Ob es sinnvoll ist, die Eigenschaften des natürlichen Hämoglobins möglichst exakt zu imitieren, darüber ist die Fachwelt sich uneins.
Zwei Argumente sprechen dafür, sich vom Vorbild zu lösen: Zum einen kommt ein Blutersatzstoff meist in extremen Ausnahmesituationen zum Einsatz, in denen womöglich Blut gar nicht die optimalen Eigenschaften hat - zum anderen hat Blut keineswegs immer die gleichen Eigenschaften: Der Regulator 2,3-DPG steuert die Bindungsstärke zum Sauerstoff je nach Situation, so dass es gar keinen spezifischen Richtwert gibt. Derzeit allerdings existieren dafür noch keine experimentellen Daten von Mensch und Tier, aus denen man die optimale Sauerstoffaffinität eines Blutersatzes ableiten könnte.
Was wurde aus den Perfluorkohlenwasserstoffen?
Lange Zeit galten die Perfluorkohlenwasserstoffe (PFC) als aussichtsreichster Ersatz für Spenderblut – so aussichtsreich, dass diese Stoffe sogar angeblich als Dopingmittel eingesetzt werden. Diese Moleküle haben die gleiche Struktur wie Kohlenwasserstoffe, mit dem Unterschied, dass alle Wasserstoffatome bei ihnen durch Fluor ersetzt wurden. In den PFC löst sich Sauerstoff außergewöhnlich gut. Perfluorierte Stoffe werden außerdem weder von Mikroorganismen angegriffen noch im Körper abgebaut, und sie sind lange haltbar. Die Forschung an diesen Stoffen begann Ende der 1960er Jahre, als Forscher demonstrierten, dass eine Maus mit Sauerstoff gesättigtes Fluorbutyltetrahydrofuran atmen kann.
PFC sind nicht in Wasser löslich, sondern werden in Form einer Emulsion verabreicht. Die winzigen Tröpfchen stabilisiert man dabei mit oberflächenaktiven Stoffen, die sich meist von den Phospholipiden des Eigelbs ableiten. Die Tropfen selbst müssen stabil gegenüber Hitzebehandlung sein, die Krankheitserreger abtötet, und klein genug, dass sie nicht von weißen Blutzellen gefressen werden. Zudem verbessern kleine Tröpfchen den Sauerstofftransport, und das ist dringend nötig: PFC brauchen einen höheren Sauerstoffanteil in der Atemluft, um wirklich effektiv zu sein; damit sind sie keineswegs universell einsetzbar.
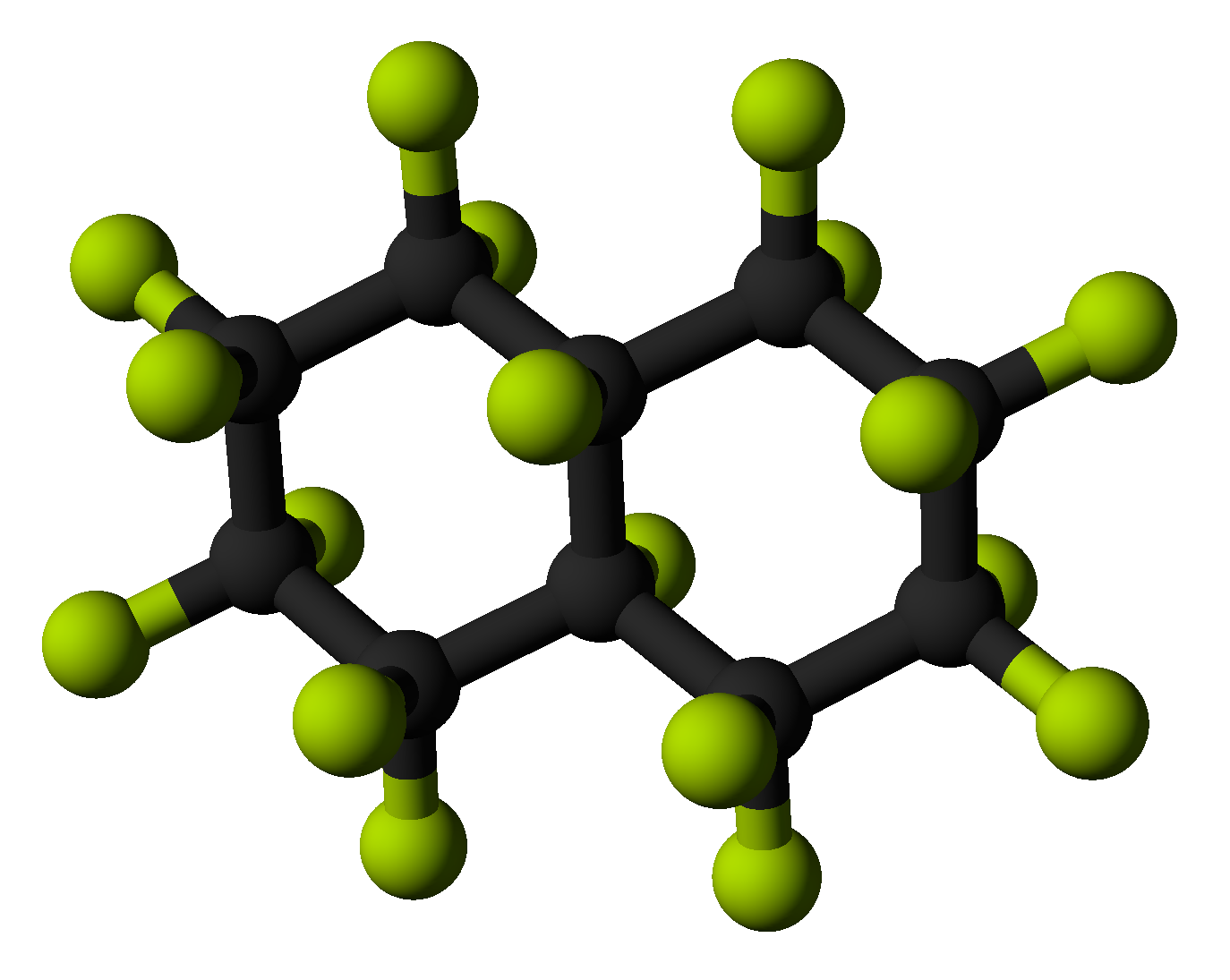
Bisher hat sich auch keines dieser Moleküle als ideal erwiesen – und die Auswahl ist weniger groß, als man meinen sollte. Zu kleine PFC können, weil sie so leicht verdampfen, sogar Gefäßprobleme verursachen. Außerdem werden sie sehr schnell ausgeschieden, so dass sie ihre Funktion nur unzureichend erfüllen. Umgekehrt dürfen die Moleküle auch nicht zu schwer werden. Ab etwa zehn Kohlenstoffatomen im Molekül wird der Stoff so groß, dass er über mehrere Jahre im Gewebe verbleibt – eine inakzeptable Langzeitbelastung.
All diese Probleme führten dazu, dass die PFC heute nur eine geringe Rolle spielen. Die erste kommerzielle PFC-Lösung blieb kaum fünf Jahre auf dem Markt – sie war zu kompliziert in der Handhabung. In Russland ist seit 1997 ein Präparat namens Perftoran zugelassen – weitere Ersatzstoffe waren und sind derzeit in der Entwicklung. Allerdings scheiterte eine der aussichtsreichsten Substanzen namens Oxygent in einer späten Phase der Versuche an einer erhöhten Schlaganfall-Wahrscheinlichkeit – ein unrühmliches Ende kurz vor dem Ziel, symptomatisch für Studien mit dieser Stoffklasse.
Ist gereinigtes Hämoglobin eine Alternative?
Wegen solcher Schwierigkeiten gelten chemisch veränderte Hämoglobin-Präparate als aussichtsreicher, obwohl sie einige Nachteile klassischer Blutkonserven mit sich bringen. Das Hämoglobin stammt dabei entweder vom Menschen oder vom Rind. Anders als synthetische Ersatzstoffe können diese Krankheitserreger enthalten, und auch sie leiden am Problem der höheren Sauerstoffaffinität durch fehlendes 2,3-DPG.
Ideal wäre, wenn man funktionierendes Hämoglobin rekombinant herstellen könnte, also mit Hilfe gentechnisch veränderter Organismen, wie Insulin zum Beispiel. Das funktioniert derzeit aber nur zum Teil: Wie man die Proteinketten korrekt faltet und die für den Sauerstofftransport entscheidenden Häm-Gruppen an der richtigen Stelle einfügt, ist im Moment noch unklar.
Das Grundproblem bei Hämoglobin ist allerdings ein anderes: Es ist giftig – deswegen ist es im Körper normalerweise gut verpackt in den roten Blutkörperchen. "Nacktes" Hämoglobin als Sauerstoffträger zu verwenden, scheitert an seiner Reaktivität: Das freie Hämoglobin wird leicht oxidiert, es reagiert mit Sauerstoff und ist dann unbrauchbar, oder es erzeugt bei solchen Reaktionen sogar unerwünschte Stoffe.
Außerdem ist der Proteinkomplex aus vier Peptidketten bei den im Blut erreichbaren Konzentrationen – bestenfalls ein Viertel jener im roten Blutkörperchen – instabil und zerfällt in seine Untereinheiten. Das zerfallene Hämoglobin schädigt die Nieren und andere Organe. Nicht zuletzt verschwindet das nackte Hämoglobin sehr schnell durch die Gefäßwände ins Gewebe, wo es für die Sauerstoffversorgung verloren ist.
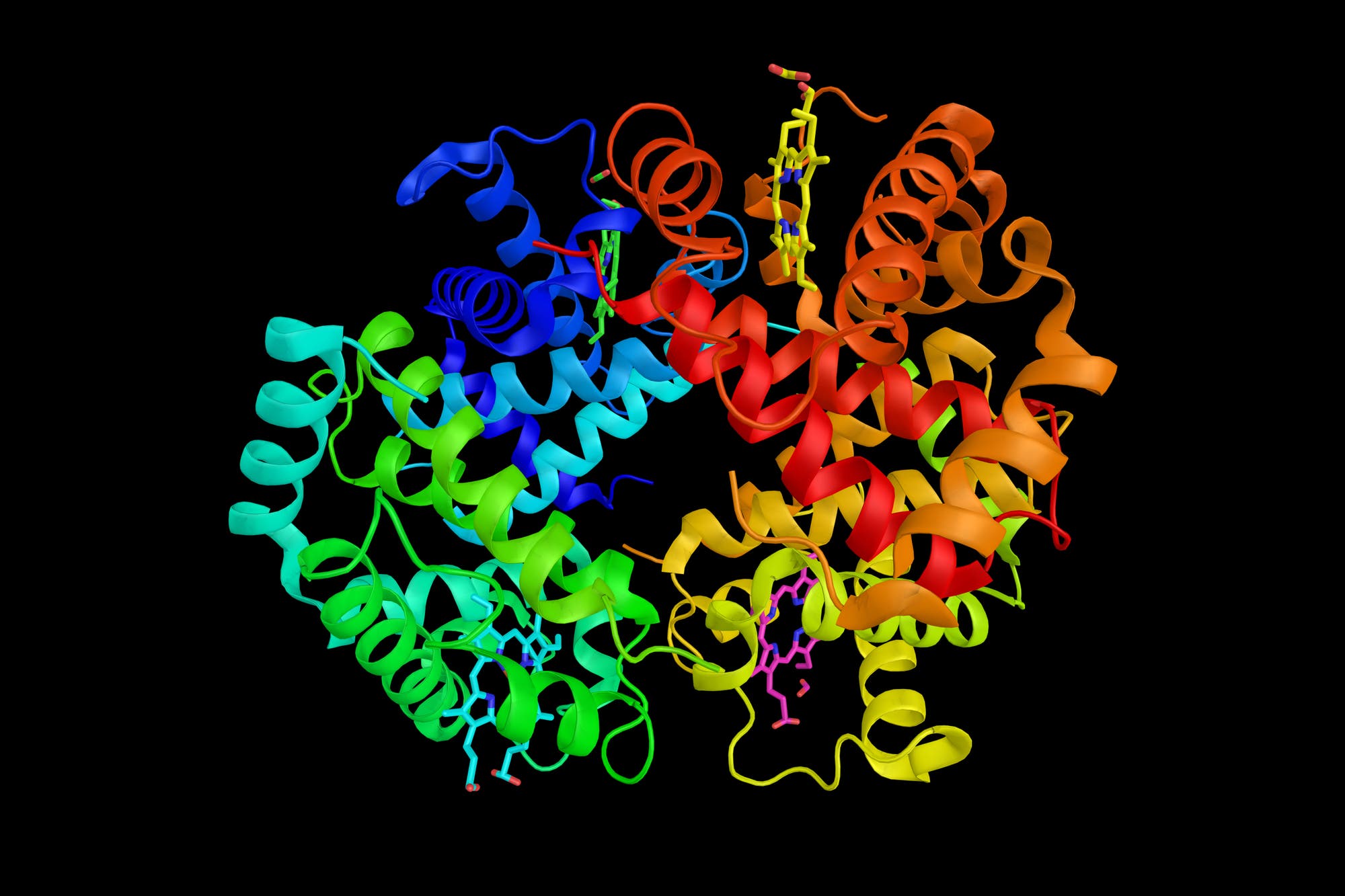
Abhilfe schaffen verschiedene Ansätze, das Hämoglobin chemisch zu verändern. So kann man die zu hohe Sauerstoffaffinität durch eine chemische Reaktion mit 2,3-DPG und einem weiteren Kofaktor lösen. Auch der Zerfall des Proteins lässt sich durch eine einfache chemische Reaktion beheben. Man geht aber noch weiter. Es hat sich als vorteilhaft erwiesen, zehn oder mehr Hämoglobinmoleküle chemisch miteinander zu verbinden. Das löst gleich zwei Probleme: Zum einen verschwinden die großen Aggregate nicht mehr so schnell aus der Blutbahn, zum anderen wird ihre Neigung, Wasser osmotisch in die Gefäße zu ziehen, mit steigender Molekülgröße geringer. In einer anderen Variante koppelt man das Hämoglobin chemisch an große Biomoleküle.
Wird es jemals einen echten Ersatz für Blut geben?
Bisher haben klinische Versuche vor allem gezeigt, dass die chemisch modifizierten Hämoglobine nicht das Gelbe vom Ei sind. So traten in Studien mit polymerisiertem Hämoglobin häufiger Herzinfarkte auf. Außerdem binden solche Stoffe sehr effektiv Stickstoffmonoxid, einen Signalstoff, der die Gefäße erweitert. Dadurch steigt der Blutdruck. Zusätzlich traten in klinischen Studien Gerinnungsstörungen und Thrombosen auf, in einigen Fällen auch Organschäden.
Insgesamt sind die Daten über die Performance der Blutersatzstoffe widersprüchlich – denn solche Werte sind im Lebewesen sehr schwer zu messen. Einige Ergebnisse deuten darauf hin, dass polymerisiertes Hämoglobin den Körper etwa vier bis sechs Stunden mit Sauerstoff versorgen kann. Mit zunehmender Oxidation des Hämoglobins jedoch nehmen die Zeichen für Sauerstoffmangel im Gewebe schnell zu.
Eine Lösung für all diese Probleme wäre, rote Blutzellen künstlich nachzubauen, das Molekül also zum Beispiel in einer Hülle aus künstlichen Lipiden zu verkapseln. Solche Konstruktionen werden deutlich komplexer als modifiziertes Hämoglobin; sie brauchen zum Beispiel auch eine Möglichkeit, 2,3-DPG mit der Umgebung auszutauschen. Derzeit befindet sich ein derartiges Präparat namens Erythromer in einer frühen Phase seiner Entwicklung.
Noch ambitionierter sind Pläne, einfach echte rote Blutzellen in großen Mengen herzustellen, und zwar aus Stammzellen. Im Prinzip geht das: Blutstammzellen kann man schon heute aus Blut ernten und unter geeigneten Bedingungen zu Erythrozyten ausdifferenzieren lassen. Der Haken daran: Das Verfahren ist immens teuer und aufwändig: Eine einzelne Blutkonserve auf diese Weise herzustellen, kostet womöglich hohe sechsstellige Beträge. Solche Präparate wären wiederum nicht viel länger als 42 Tage haltbar.
Ob Verfahren auf Basis von reprogrammierten Hautzellen immerhin einfacher und billiger sind, ist noch völlig unklar. So schwierig echte rote Blutzellen nachzuzüchten sind, synthetische Ersatzstoffe haben es inzwischen merklich schwerer, für klinische Tests zugelassen zu werden. Die US-amerikanische Lebensmittel- und Arzneimittelbehörde FDA, Hauptanlaufstelle für Medikamentenzulassungen, gilt inzwischen als zurückhaltend bei der Genehmigung weiterer Versuche mit Ersatzstoffen. Zu schlecht waren die Erfahrungen in der Vergangenheit. Nach mehr als einem halben Jahrhundert Forschung an Ersatzstoffen zeichnet sich immer mehr ab: Der beste Ersatz für Blut bleibt Blut.



Schreiben Sie uns!
7 Beiträge anzeigen