Lexikon der Chemie: Alkane
Alkane, Paraffine, Grenzkohlenwasserstoffe, aliphatische Kohlenwasserstoffe der allg. Formel CnH2n+2. A. enthalten ausschließlich sp3-hybridisierte C-Atome, die bis zur Grenze ihrer Aufnahmefähigkeit mit Wasserstoff abgesättigt sind.
A. bilden eine homologe Reihe von Verbindungen, in der sich zwei benachbarte Glieder der Reihe durch die Gruppe -CH2- unterscheiden (Tab. 1). Ähnlichkeiten untereinander bestehen hinsichtlich der chemischen Reaktionsfähigkeit, während sich die physikalischen Eigenschaften kontinuierlich ändern.
Beginnend mit dem Butan C4H10 treten mit wachsender Kohlenstoffkette in zunehmender Anzahl Isomere auf, wobei man zwischen geradkettigen (linearen) und verzweigten A. unterscheidet. Von den Kohlenwasserstoffen C7H16 an kann ein Teil der Konstitutionsisomeren asymmetrische C-Atome enthalten, so daß eine noch größere Vielfalt durch Auftreten von Konfigurationsisomeren zu verzeichnen ist (Tab. 2). Über die Bezeichnung der A. Nomenklatur, Abschn. C III.
Alkane. Tab. 1: Homologe Reihe Alkane
| ||||
| Ethan | CH3-CH3 | Undecan | C11H24 | |
| Propan | CH3-CH2-CH3 | Dodecan | C12H26 | |
| Butan | CH3-(CH2)2-CH3 | Tridecan | C13H28 | |
| Pentan | CH3-(CH2)3-CH3 | Tetradecan | C14H30 | |
| Hexan | CH3-(CH2)4-CH3 | Pentadecan | C15H32 | |
| Heptan | CH3-(CH2)5-CH3 | Eicosan | C20H42 | |
| Octan | CH3-(CH2)6-CH3 | Triacontan | C30H62 | |
| Nonan | CH3-(CH2)7-CH3 | Tetracontan | C40H82 |
Alkane. Tab. 2: Anzahl der Isomeren
| ||||
| 1 | Methan | 1 | 1 | |
| 2 | Ethan | 1 | 1 | |
| 3 | Propan | 1 | 1 | |
| 4 | Butan | 2 | 2 | |
| 5 | Pentan | 3 | 3 | |
| 6 | Hexan | 5 | 5 | |
| 7 | Heptan | 9 | 11 | |
| 8 | Octan | 18 | 24 | |
| 9 | Nonan | 35 | 55 | |
| 10 | Decan | 75 | 136 | |
| 20 | Eicosan | 366 319 | 3 395 964 |
Eigenschaften. Die ersten vier A. der homologen Reihe sind gasförmig, die weiteren bis C16 flüssig, und die Homologen ab C17 sind fest. Die Siedepunkte verzweigter A. sind niedriger als die der isomeren linearen A. Mit dem Ansteigen der Siedepunkte in der homologen Reihe werden die Unterschiede zwischen benachbarten A. geringer und damit eine destillative Trennung schwieriger. Die gasförmigen und festen A. sind fast geruchlos, die Flüssigkeiten weisen meist typischen Benzingeruch auf. Die A. sind nicht mit Wasser mischbar. Sie lösen sich in Ether und Ethanol; dabei nimmt die Löslichkeit jedoch mit steigender Molmasse ab. A. sind brennbar, die niedermolekularen gasförmigen und flüssigen Verbindungen sind leichter entflammbar als die höheren Homologen und bilden außerdem mit Luft oder Sauerstoff explosive Mischungen. Die vollständige Verbrennung führt zu Kohlendioxid und Wasser, unvollständige Verbrennung zu Kohlenmonoxid oder Ruß. Obwohl die Reaktionsfähigkeit der A. im Vergleich zu vielen anderen Verbindungsklassen relativ gering ist, lassen sich meist unter den Bedingungen für radikalische Reaktionen Umsetzungen durchführen, die vorwiegend großtechnisch genutzt werden. Die Reaktivität verzweigter A. ist dabei allgemein höher als die der linearen A.
Vorkommenfür A. sind Erdgas- und Erdöllagerstätten, deren zunehmende Ausbeutung von hoher technischer Aktualität ist. Petrolchemische Verarbeitung ermöglicht die Bereitstellung reiner A. als auch verschiedener Fraktionen von Alkangemischen.
Herstellung.A. werden meist großtechnisch aus Erdgas, Erdöl oder vereinzelt durch Kohleverflüssigung gewonnen. Für wissenschaftliche Zwecke eignen sich folgende Synthesemethoden:
1) Katalytische Hydrierung von Alkenen und Alkinen: R1-C≡C-R2 + H2 → R1-CH=CH-R2 + H2 → R1-CH2-CH2-R2.
2) Reduktion von Alkoholen bzw. Alkyliodiden mit Iodwasserstoffsäure: R-OH + HI → R-I + H2O, R-I + HI → R-H + I2. Die Reaktion wird am besten mit einem Gemisch von Iodwasserstoffsäure und rotem Phosphor ausgeführt, da dann der verbrauchte Iodwasserstoff regeneriert wird:
2 P + 3 I2 → 2 PI3, 2 PI3 + 6 H2O → 2 P(OH)3 + 6 HI.
3) Hydrolyse von Grignard-Verbindungen: RMgX + H2O → R-H + Mg(OH)X.
4) Umsetzungen von Alkylhalogeniden mit Natrium (→ Wurtz-Reaktion).
5) Elektrolyse der Alkalisalze von Carbonsäuren in wäßrigen Lösungen (Kolbe-Synthese), die sich ebenso wie die Wurtz-Reaktion zur Darstellung langkettiger A. eignet.
6) Aldehyde und Ketone kann man über die Wolff-Kishner-Reduktion der Hydrazone oder die direkte Reduktion mit Zinkamalgam Clemmensen-Reduktion in A. umwandeln.
Reaktionen. Typisch für A. sind radikalische Substitutionsreaktionen. So entstehen z. B. durch Einwirkung von Chlor bei höherer Temperatur und gleichzeitiger Bestrahlung mit UV-Licht durch Gasphasenchlorierung von Methan nebeneinander Chlormethan, Dichlormethan, Chloroform und Tetrachlorkohlenstoff:
CH4 + Cl2 → CH3Cl/CH2Cl2/CHCl3/CCl4.
Durch Wahl der Reaktionsbedingungen und der Stoffkonzentration können bestimmte Anteile in höherer Ausbeute erhalten werden, die Auftrennung erfolgt durch fraktionierte Destillation.
Mit einem Chlor/Schwefeldioxid-Gemisch werden Sulfonylchloride erhalten:
R-H + Cl· → R· + H-Cl
R· + SO2 → R-SO2·
R-SO2· + Cl2 → R-SO2Cl + Cl·
Alkansulfonylchlorid
Die Endprodukte dieser radikalischen Kettenreaktion, die technisch an langkettigen A. erfolgt, sind wertvolle Zwischenprodukte für die Herstellung von Tensiden. Die Sulfoxidation mit Schwefeldioxid und Sauerstoff führt zu Gemischen von Alkansulfonsäuren: 2 R-H + 2 SO2 + O2 → 2 R-SO3. Durch Nitrierung von A. in der Gasphase bei 400 °C mit Salpetersäure erhält man Gemische von isomeren Nitroalkanen und durch partielle oxidative Spaltung auch niedermolekulare Nitroalkane:
CH3-CH2-CH3 → CH3-CH2-CH2-NO2/CH3-CH-CH3 (1-Nitropropan/
|
NO2
2-Nitropropan) und CH3-CH2-NO2/CH3-NO2 (Nitroethan/Nitromethan). Die Nitrosierung mit Nitrosylchlorid NOCl führt zu Nitrosoalkanen, die zu Oximen umgelagert werden können:
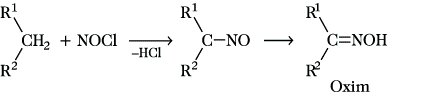
Solche Reaktionen haben Bedeutung für die Herstellung von Polyamiden durch anschließende Beckmann-Umlagerung. Die Oxidation von A. führt im Überschuß von Luft oder Sauerstoff bei der Verbrennung zum völligen Abbau zu CO2 und H2O, bei unvollständiger Verbrennung auch teilweise zu CO oder zu Ruß. Letztgenannte Reaktion wird beim Methan gezielt technisch zur Rußerzeugung als Füllstoff für die Reifenherstellung genutzt. Kontrollierte Oxidationsreaktionen können auch so geführt werden, daß unter C-C-Spaltung aus langkettigen A. niedere oder mittlere Carbonsäuren entstehen (Paraffinoxidation).
In der Gegenwart gewinnen zunehmend auch ionische Reaktionen an A. Bedeutung. Dazu gehören Umlagerungen und Isomerisierungen, z. B. die Umwandlung von Butan in Isobutan beim Erhitzen mit Aluminium-(III)-chlorid. Reaktionen, die im Laboratorium eine rasche Identifizierung von A. durch Derivatbildung ermöglichen, sind nicht bekannt. Zur Charakterisierung müssen deshalb physikalische Konstanten und spektroskopische Daten herangezogen werden. Die Trennung von Gemischen und die Identifizierung der Einzelkomponenten erfolgt meist durch die Kombination von Gaschromatographie und Massenspektrometrie (GC-MS-Kopplung).
Verwendung.A. werden als Heizgase, z. B. Stadtgas (Methan), Flüssiggas (Propan und Butan) in Industrie, Gewerbe, Haushalt, für Sport- und Freizeitbeschäftigung verwendet. Die flüssigen A. C5 bis C16 werden als Vergaserkraftstoffe, Dieselöle, Heizöle oder Schmieröle verwendet. Besondere Vorsicht beim Umgang mit A. bis etwa C10 (Heizgas, Flüssiggas, Benzine) ist wegen der Bildung explosiver Gemische mit Luft oder Sauerstoff geboten. Andererseits beruht die Verwendung als Antriebsmittel für Kraftfahrzeuge, Schiffe, Eisenbahnen u. dgl. auf dem Prinzip der schnellen, nahezu explosionsartig verlaufenden Verbrennung, wobei verzweigte A. von besonderer Bedeutung für eine gleichmäßige, rückstandsfreie und gesteuerte Verbrennung ohne "Klopfen" des Motors (Octanzahl) sind. Reine A. verschiedener Kettenlänge, z. B. Pentan oder Hexan, sind als Extraktions- und Lösungsmittel geeignet. Die halbfesten und festen Alkangemische ab C16/C17 werden als Vaseline, Weich- und Hartparaffine für Salbengrundlagen, pharmazeutische Präparate, medizinische Paraffinpackungen und zur Herstellung von Kerzen verwendet.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.