Lexikon der Chemie: elektrophile Reaktionen
elektrophile Reaktionen, Umsetzungen von Elektrophilen (elektronensuchende Teilchen) mit Substraten erhöhter Elektronendichte (nucleophile Verbindungen wie Alkene oder Arene). Dem Reaktionsweg nach unterscheidet man zwischen elektrophilen Additionsreaktionen (AE) und elektrophilen Substitutionsreaktionen (SE), wobei alle Reaktionen zweistufig ablaufen. In der ersten Stufe, die für beide Mechanismen identisch ist, bildet sich durch Anlagerung des Elektrophils an eine π-Bindung ein π-Komplex (s. Abb.). Ob die Reaktion als Addition oder Substitution weiterläuft, hängt von der thermodynamischen Stabilität des Endproduktes ab. Während Arene, z. B. Benzol, praktisch ausschließlich unter Substitution reagieren (Abspaltung eines Protons), addieren Alkene das zum Elektrophil vorhandene Gegen-Ion (Br- in der Abb.).

elektrophile Reaktionen. Abb.: Reaktionsschema.
Im Verlauf der Reaktion lagert sich der π-Komplex in einem langsamen, geschwindigkeitsbestimmenden Schritt in einen σ-Komplex (Carbenium-Ion) um, der bei Aromaten ein H+ unter Wiederherstellung des energiearmen aromatischen Zustands abspaltet (Substitutionsprodukt) bzw. bei der AE-Reaktion das negative Gegenion addiert (Addukt).
Wichtige SE-Reaktionen sind u. a. Bromierung, Nitrierung, Sulfonierung oder Friedel-Crafts-Acylierung (Arene), bedeutsame AE-Reaktionen sind die Addition von Halogenen, Halogenwasserstoffen, Wasser, Alkohole u. a. (Alkene). Bei längerkettigen und verzweigten Alkenen verlaufen diese Umsetzungen regioselektiv nach der Markownikoffschen Regel oder stereoselektiv als cis- oder trans-Addition je nach Struktur des Substrates. Eine theoretische Erklärung für cis- oder trans-Addition gibt die Formulierung überbrückter symmetrischer bzw. unsymmetrischer Kationen:
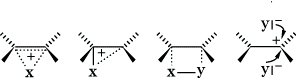
Wenn das überbrückte Kation stabiler ist als das Carbenium-Ion, kann das Nucleophil Y (z. B. Br-) in Analogie zum SN2-Mechanismus nur an der Rückseite angreifen, es resultiert das trans-Addukt. Wenn das Carbenium-Ion stabiler ist (z. B. Addition von Halogenen an Alkene), sind zwei Fälle zu unterscheiden: 1. Das Carbenium-Ion bildet mit dem Reagens einen viergliedrigen Übergangszustand, aus dem heraus Heterolyse zu einem kurzlebigen inneren Ionenpaar erfolgt. Die Reaktion erfolgt stereospezifisch als cis-Addition (z. B. Hydroborierung von Alkenen). 2. Das Carbenium-Ion hat eine genügend lange Lebensdauer, so daß sich das Nucleophil von beiden Seiten zu einem thermodynamisch kontrollierten Produktgemisch anlagert (z. B. Addition von Wasser, Alkoholen, Carbonsäuren an Alkene).
Welche Variante des Mechanismus vorliegt, hängt von der Struktur des Substrates und von der Art des Reagens ab.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.