Lexikon der Chemie: Ether
Ether, organische Verbindungen der allg. Formel R-O-R', wobei R und R' beliebige Alkyl- oder Arylreste sein können. Man kann E. als Anhydride von Alkoholen und/oder Phenolen auffassen oder auch als Substitutionsprodukte des Wassers ansehen, wobei beide H-Atome durch Kohlenwasserstoffreste ersetzt sind.
Man unterscheidet symmetrische (einfache) E., bei denen R = R' ist, und unsymmetrische (gemischte) E., bei denen R und R' verschiedene Kohlenwasserstoffreste darstellen. Nach der Art der Reste unterscheidet man ferner Dialkylether, Diarylether, Enolether und Alkylarylether (Phenolether).
Bezeichnung. Symmetrische E. werden als Dialkyl-, Dicycloalkyl- oder Diarylether bezeichnet, z. B. Diethylether oder Diphenylether. Unsymmetrische E. werden als Alkoxy-, Cycloalkoxy- oder Aryloxyderivate von Kohlenwasserstoffen betrachtet. Der Kohlenwasserstoff mit der größten Anzahl von C-Atomen zählt als Stammverbindung, z. B. Methoxyethan oder Methoxybenzol. Vielfach sind für unsymmetrische E. noch Bezeichnungen wie Ethylmethylether oder unkorrekt Methylethylether im Gebrauch. Zugelassene Trivialnamen, besonders für Phenolether, sind z. B. Anisol und Nerolin. Der wichtige Diethylether wird oft kurz als E. bezeichnet.
Eigenschaften. Dimethylether und Methoxyethan sind bei Zimmertemperatur gasförmig, die nächsten Homologen sind leichtbewegliche, flüchtige und niedrig siedende Flüssigkeiten. Da sie keine Wasserstoffbrückenbindungen ausbilden können und folglich nicht assoziiert sind, sind sie flüchtiger als Alkohole oder Phenole mit gleicher Anzahl von C-Atomen. Sie haben eine geringere Dichte als Wasser und sind in diesem meist nicht löslich. Viele E. weisen einen angenehmen ("ätherischen") Geruch auf und werden deshalb für Parfümkompositionen verwendet. Die niederen E. sind leicht entflammbar und verbrennen mit Luftsauerstoff mit leuchtender Flamme.
Beim Umgang mit Ether sind alle einschlägigen Arbeitsvorschriften genauestens einzuhalten, da die Dämpfe mit Luft explosive Gemische bilden. Bei längerem Stehen an der Luft bilden sich außerdem Etherperoxide, die beim Erwärmen explosionsartig zerfallen (s. u.). Bei Anwesenheit von metallischem Kupfer, Diphenylamin, Naphthalin und Benzidin findet die Peroxidbildung nicht statt.
Reaktionen. E. sind sehr beständige Verbindungen und eignen sich deshalb als indifferente Lösungsmittel für chemische Reaktionen. Da sie in den meisten Fällen von Natrium nicht angegriffen werden, lassen sie sich mit diesem Metall trocknen. Beim Lösen von E. in konz. starken Säuren, wie Schwefelsäure, Perchlorsäure, Salzsäure oder Iodwasserstoffsäure, bilden sich Oxoniumsalze:
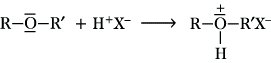
Mit Lewis-Säuren bilden E. Komplexe. Das Addukt aus Diethylether und Bortrifluorid (Bortrifluoridetherat) kann sogar destilliert werden. Durch weitere Umsetzung derartiger Komplexe mit Fluoralkanen entstehen tertiäre Oxoniumsalze.
Diarylether gehen alle diese Reaktionen nicht ein. Mit konz. Iodwasserstoff- oder Bromwasserstoffsäure werden Dialkyl- und Arylalkylether in ein Gemisch von Halogenalkan und Alkohol bzw. Phenol gespalten (Etherspaltung): R-O-R + HI → R-I + R-OH.
Die Umsetzung verläuft ebenfalls über die Bildung von Oxoniumsalzen. Die Etherspaltung wird zur quantitativen Bestimmung von Methoxy- oder Ethoxygruppen nach Zeisel benutzt. Durch Autoxidation bilden sich aus E. beim längeren Stehen an der Luft Hydroperoxide und Peroxide:
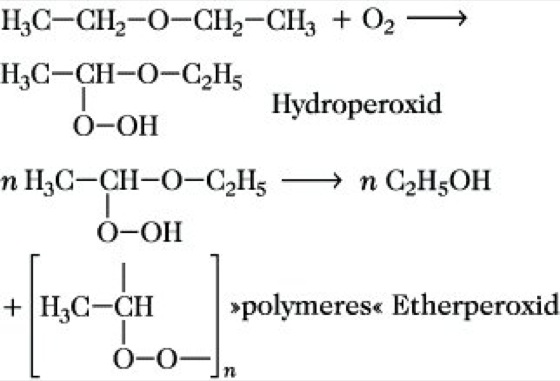
Die Etherperoxide sind polymere, schwerflüchtige, ölige Flüssigkeiten von stechendem Geruch, die sich bei der Destillation von E. im Rückstand anreichern und beim Erwärmen explosionsartig zerfallen. Man muß deshalb vor der Verwendung von E. mit Titan(IV)-oxidsulfat oder Eisen(II)-Salzen und Rhodanid-Ionen prüfen, ob Peroxide enthalten sind. Diese sind gegebenenfalls mit Natrium, Eisen(II)- oder Mangan(II)-Salzen reduktiv zu zerstören.
Die Herstellung von E. geht meist von Alkoholen oder Phenolen aus. 1) Vorwiegend symmetrische E. erhält man bei der intermolekularen Dehydratisierung von Alkoholen mittels konz. Schwefelsäure, wasserfreier Phosphorsäure oder Aluminiumoxidkatalysatoren: 2 R-OH → R-O-R + H2O. 2) Symmetrische und auch unsymmetrische E. sind durch die säurekatalysierte Addition von Alkoholen an Alkene zugänglich:
3) Besonders gut geeignet zur Herstellung von Dialkyl- und Arylalkylethern ist die Williamson-Synthese aus Alkoholaten oder Phenolaten und Halogenalkanen. 4) Zur Synthese von Phenolethern eignet sich außerdem die Alkylierung von Phenolen mit Dialkylsulfaten in alkalischer Lösung sowie die Methylierung mit Diazomethan.
Verwendung. E. werden aufgrund ihres ausgezeichneten Lösungsvermögens für viele organische Verbindungen als Lösungs- und Extraktionsmittel verwendet. Außerdem dienen sie als Riechstoffe für Geruchskompositionen, als Weichmacher, als Desinfektionsmittel und als Anästhetika.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.