Lexikon der Chemie: Methan
Methan, CH4, die erste Verbindung der homologen Reihe der Alkane, ein farbloses, geruchloses und ungiftiges Gas; F. -182,6 °C, Kp. -161,7 °C. M. ist in Wasser sehr wenig löslich, besser löslich ist es in organischen Lösungsmitteln. Mit Luft oder Sauerstoff verbrennt es mit schwach leuchtender Flamme. Gemische mit Luft oder Sauerstoff sind leicht entzündlich und explosiv. Besonders gefährlich sind Gemische von M. mit dem zweifachen Volumen Sauerstoff oder dem zehnfachen Luftvolumen ("schlagende Wetter"). Bei unvollständiger Verbrennung entsteht Gasruß: CH4 + O2 → C + 2 H2O. Mit Chlor reagiert M. unter direkter Sonnenlichtbestrahlung explosionsartig unter Abscheidung von Kohlenstoff: CH4 + 2 Cl2 → C + 4 HCl. Im diffusen Tageslicht werden die H-Atome des M. stufenweise durch Cl-Atome substituiert. Das ist von großer Bedeutung für die technische Gewinnung von Methylchlorid, Dichlormethan, Chloroform und Tetrachlorkohlenstoff. Brom reagiert wie Chlor, aber weitaus träger, Iod dagegen nicht mehr. Mit Wasserdampf wird M. bei 800 bis 900 °C in Gegenwart von Nickelkatalysatoren zu Synthesegas umgesetzt: CH4 + H2O → CO + 3 H2 (Dampfreforming).
Durch partielle Oxidation von M. in Gegenwart von Ammoniak nach dem Andrussow-Verfahren gewinnt man Cyanwasserstoff:
Technische Bedeutung hat auch die Herstellung von Acetylen durch Hochtemperaturpyrolyse von M. sowie die Nitrierung zu Nitromethan.
Vorkommen und Gewinnung. M. ist der Hauptbestandteil des Erdgases, es findet sich ferner als Grubengas eingeschlossen in Steinkohlenflözen und gemeinsam mit Kohlendioxid im Sumpfgas, das im Bodenschlamm von Seen und in Sümpfen durch anaerobe Vergärung von Cellulose entsteht. Durch analoge Prozesse wird es auch im Pansen von Wiederkäuern (Methangärung) oder beim Abbau von Fäkalien gebildet (Biogas). M. entsteht weiterhin bei der Verkokung oder Schwelung von Stein- oder Braunkohle, Torf und Holz sowie bei Crackprozessen in der Erdölverarbeitung. Für industrielle Zwecke wird es in großtechnischem Maßstab aus Erdgas abgetrennt, durch Crack- oder Schwelprozesse hergestellt oder aus Kohlenmonoxid bzw. Kohlendioxid und Wasserstoff synthetisiert:
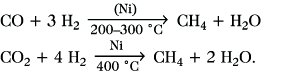
Als Heizgas wird M. auch durch Schlammvergärung der Cellulosebestandteile von Kläranlagen (Emscherbrunnen-Verfahren), von Stalldung, Stroh und Kartoffelkraut gewonnen.
Im Laboratorium stellt man M. durch Zersetzung von Aluminiumcarbid mit Wasser, durch Erhitzen von Natriumacetat mit Natriumhydroxid oder durch Hydrolyse von Methylmagnesiumhalogeniden her.

Methan. Abb.: Synthesen mit Methan.
Verwendung. M. wird als Heizgas, Stadtgas und Treibgas verwendet und dient als Ausgangsstoff für eine Reihe wichtiger Synthesen (Abb.).
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.