Lexikon der Neurowissenschaft: beta-Amyloid-Vorläuferprotein
β-Amyloid-Vorläuferprotein s [von griech. amylon = Stärke], E β-amyloid precursor protein (Abk. APP), Transmembranprotein, das zu sekretierten Teilstücken prozessiert wird und mit verschiedenen Funktionen, wie z.B. Regulation der Blutstillung und Schutz der Nervenzellen vor schädigenden Einflüssen (Neuroprotektion), aber auch mit der Alzheimer-Krankheit in Verbindung gebracht wird. Außerdem besitzt APP wichtige Metall- und Heparin-bindende Eigenschaften. Die derzeitige Herausforderung der Forschung über APP ist die Integration all dieser Eigenschaften in ein zusammenhängendes Funktionskonzept. – APP wird in den verschiedensten Körperzellen synthetisiert und als Transmembranprotein auf der Oberfläche von Zellen exprimiert. Durch alternatives Spleißen entstehen bis zu 8 verschiedene Isoformen des Proteins mit erhaltener Aβ-Sequenz ( siehe Abb. ). Durch verschiedene Sekretasen werden unterschiedlich lange Bruchstücke am extrazellulären Anteil das APPs abgespalten. Die α-Sekretase spaltet das APP in der Mitte der Aβ-Region: es entsteht ein Fragment, welches als sekretorisches APP bezeichnet wird. Dieses zeigt in vitro neuroprotektive Eigenschaften. Wahrscheinlich ist darin auch die natürliche Funktion des APP zu sehen. APP-Spaltung durch β- und γ-Sekretasen führt hingegen zur Bildung des neurotoxischen Aβ-Peptids (β-Amyloid-Peptid; Alzheimer-Krankheit). Neueste Erkenntnisse weisen darauf hin, daß die Stelle, an welcher die γ-Sekretase spaltet, kritisch ist für das Maß der Ablagerung von Amyloid im Zentralnervensystem; Aβ 1-42 ist viel stärker amyloidbildend als Aβ 1-40. Die Bildung von Aβ 1-42 wird außerdem noch gefördert durch Mutationen in den 2 Präsenilin-Genen (PS1 und PS2) und durch die bereits bekannten APP-Genmutationen. Transgene Tiermodelle für die Alzheimer-Krankheit, welche verschiedene Mutationen im Präsenilin-Gen aufweisen, werden derzeit untersucht und zeigen β-Amyloid-Ablagerungen sowie Störungen der kognitiven Fähigkeiten. – Eine gestörte APP-Verarbeitung gefährdet Nervenzellen nicht nur durch Aggregation von neurotoxischem β-Amyloid-Peptid, sondern auch durch die damit verbundene Reduktion der sekretierten Form von APP, was genauso wie β-Amyloid-Peptid einen Einfluß auf die Erregbarkeit der Neuronen und deren Resistenz gegen excitotoxische, metabolische und oxidative Streßfaktoren hat. – Zusammenfassend betrachtet könnte also eine gestörte Balance der verschiedenen APP-spaltenden Enzyme (Sekretasen) für die Ausbildung der Alzheimer-Krankheit eine wichtige Rolle spielen. Die Beeinflussung der Sekretasen ist daher ein mögliches Ziel bei der künftigen Behandlung von Alzheimer-Patienten.
A.A./G.H.
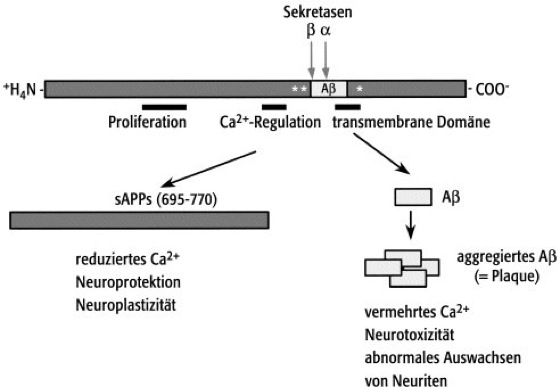
β-Amyloid-Vorläuferprotein
Spaltung des Vorläuferproteins führt zu sezernierten Formen mit neurotrophischen und neuroprotektiven Eigenschaften. Bei der Alzheimer-Krankheit führt abnormale Spaltung zu vermehrter Bildung des amyloidogenen Aβ-Peptids. Einzelne Domänen des Vorläuferproteins mit bekannter Funktion sind gekennzeichnet.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.