Optogenetik: Per Lichtpuls das Gehirn kontrollieren
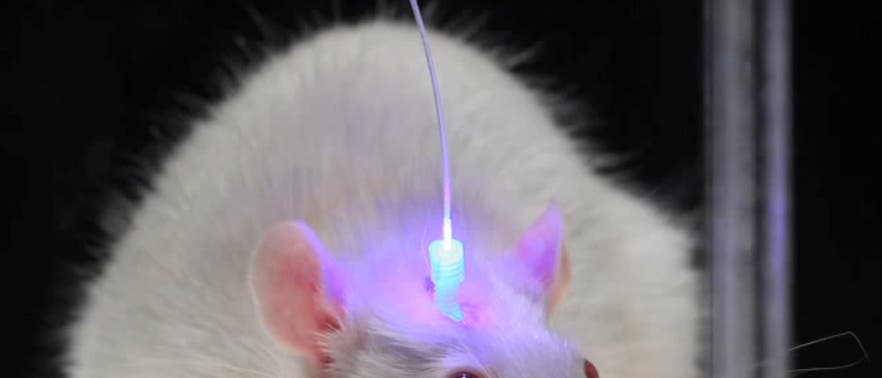
© Viviana Gradinaru, John Carnett, Karl Deisseroth (Ausschnitt)
Als sich Francis Crick, der berühmte Mitentdecker der DNA-Struktur, im Jahr 1979 in einem Spektrum-Artikel Gedanken über das Gehirn machte, formulierte er auch eine Wunschliste neuer Techniken – solche nämlich, die uns helfen würden, unser Verständnis der Informationsverarbeitung im Gehirn fundamental zu verbessern. Weit oben auf der Liste stand eine Methode, mittels derer sich Einfluss auf spezifische Typen von Neuronen gewinnen ließe, "ohne dass andere davon nennenswert beeinträchtigt würden".
Dank der Optogenetik, welche die Genetik mit optischer Technik kombiniert (siehe Die Erleuchtung des Gehirns, SdW 5/2009), gewinnt Cricks Vision nun allmählich Gestalt. Seit einigen Jahren erst wird die neue Disziplin entwickelt, stößt aber schon auf breites Interesse, weil sie Wissenschaftler in die Lage versetzt, das Verhalten von Tieren zu manipulieren. So konnte eine Forschergruppe demonstrieren, dass Licht, eingestrahlt in das auf genetischem Weg ansteuerbar gemachte Gehirn von Mäusen, die Tiere dazu veranlasst, endlos im Kreis herumzulaufen.
Auch die Öffentlichkeit hat die Möglichkeit solcher Kunststücke bereits registriert und der US-Komiker und Moderator Jay Leno träumte schon 2006 von einer optogenetisch manipulierten Fliege, mittels derer sich George W. Bush nachhaltig drangsalieren ließe. Doch die Bedeutung der Optogenetik geht weit über ihre Verwendbarkeit in Comedy-Sendungen und pessimistischer Sciencefiction hinaus. Sie hat sich als wichtigste der neuen Technologien entwickelt, mittels derer wir die überwältigend komplexen Verschaltungen in den Gehirnen von Säugetieren besser verstehen können. Bereits jetzt liefert sie zum Beispiel Erkenntnisse über die Zusammenhänge zwischen "Fehlverdrahtungen" im Gehirn und neurologischen oder mentalen Störungen wie etwa der Parkinsonkrankheit und der Schizophrenie.
Gezielt an- und abschalten
Ein bahnbrechendes Experiment hatten Karl Deisseroth und seine Kollegen von der kalifornischen Stanford University und vom Frankfurter Max-Planck-Institut für Biophysik im Jahr 2005 durchgeführt. Das Team hatte gezeigt, wie sich ein Virus nutzen lässt, um ein Gen für das so genannte Kanalrhodopsin-2 – ein lichtempfindliches Protein – in spezifische Gruppen von Neuronen einzufügen. Sind die Neuronen einmal mit dieser aus Algen gewonnenen Bauanleitung ausgestattet und produzieren das Protein, feuern die Neuronen, sobald sie Lichtpulsen ausgesetzt werden. Dieses Experiment zeigte ebenso wie weitere, die bald folgten, dass sich ausgewählte Neuronen binnen weniger Millisekunden an- oder abschalten lassen, ohne dass Nachbarzellen davon betroffen wären. Hunderte von Labors weltweit haben Deisseroths Technik seither angewendet – und der im Jahr 2004 verstorbene Francis Crick hätte diesen Punkt auf seiner Wunschliste abhaken können
Der 38-jährige Psychiater Deisseroth, der einmal pro Woche weiterhin Patienten empfängt, hatte sich aus einem ganz besimmten Grund mit der Biotechnologie zu beschäftigen begonnen: Das vorhandene Instrumentarium, um mentale und neurodegenerative Störungen zu untersuchen und zu behandeln, schien ihm unzureichend. "Den Hirnstimulations-Behandlungen, die ich als Psychiater vielfach durchgeführt habe, mangelte es ganz erheblich an Präzision. Man kann zwar genau die Zellen stimulieren, die man stimulieren will, regt dabei gleichzeitig aber auch andere an", sagt er. Ähnliche Probleme bestehen mit Medikamenten, die ebenfalls (vergleichsweise) unspezifisch wirken.
Molekularer Zauberkasten
Mittlerweile hat Deisseroths Labor, zum Teil auch in Kooperation mit führenden Neurowissenschaftlern, einen "Werkzeugkasten" entwickelt, der auf Genen für das Kanalrhodopsin-2 und weiteren Opsinen beruht. Diese Proteine (für ihre Entdeckung und neurobiologische Anwendung wurde Ernst Bamberg vom MPI für Biophysik mit dem Wissenschaftspreis des Stifterverbands 2009 ausgezeichnet) fungieren als Poren oder Kanäle in der Zellmembran, welche sie – über eine Steuerung der Kanalweite – für bestimmte Ionen durchlässiger machen können. Auf diesem Weg lassen sich somit auch Neuronen an- oder ausschalten. Der molekulare Zauberkasten verhilft Forschern zu vielfältigen Fähigkeiten: Beispielsweise können sie nun ausschließlich eine Untergruppe eines bestimmten Zelltyps beeinflussen, oder eine Verschaltung zwischen zwei Gruppen ausgewählter Neutronen in unterschiedlichen Hirnregionen stimulieren, etwa im limbischen System und im Kortex. Zudem hat Deisseroth die Methoden verfeinert, mittels derer sich die Opsine in die Zellen einbringen lassen. Üblicherweise wird dabei ein Virus als Genfähre genutzt, die sowohl Opsin-Baupläne wie auch Regulatorsequenzen transportiert.
Stellen die Zellen schließlich Opsine her, muss man die Proteine nur noch aktivieren. Dazu verbindet Deisseroths Team Laserdioden mit winzigen Glasfaserkabeln und bringt diese in das Gehirns seiner Versuchstiere ein. Zusätzlich werden Elektroden implantiert, die das Feuern der Neuronen registrieren. Im vergangenen Jahr haben sich diese Techniken erheblich weiterentwickelt, sagt Deisseroth. "Zuvor waren sie ein interessantes und nützliches Tool für eine begrenzte Zahl von Anwendungen", so der Forscher, "nun aber lassen sie sich auf beliebige Zellen oder biologische Fragestellungen anwenden."
Kontrolle über Wünsche, Bedürfnisse, Hoffnungen?
Die überzeugendsten Experimente sind indessen jene, an denen die Relevanz der Optogenetik sowohl für die Grundlagenforschung als auch die Medizin deutlich wird. Eines davon stellte Michael Häusser vom University College London im letzten Oktober vor, als sich die internationale Society for Neuroscience in Chicago traf. 100 Neuronen, so hatte sein Team nachgewiesen, konnten eine Erinnerung auslösen, die in einem viel größeren Ensemble von etwa 100 000 Neuronen gespeichert war. Offenbar lässt sich diese Technik auch nutzen, um die Bildung von Gedächtnisinhalten zu untersuchen.
Eine optogenetische Studie, die Deisseroths Gruppe in Frühjahr 2009 veröffentlicht hatte, half auch bei der Aufklärung der Funktionsweise von Tiefenhirnstimulationen, die durch das Implantieren von Elektronen im Gehirn das für Parkinson typische Zittern lindern können. Üblicherweise wird diese Wirkung durch die Aktivierung des so genannten subthalamischen Kerns im Zwischenhirn erklärt. Nun aber scheint sich herauszustellen, dass die Elektroden ihre Wirkung auf Nervenfasern ausüben, die vom Motorcortex und möglicherweise weiteren Gehirnregionen in den subthalamischen Kerns gelangen. Diese Erkenntnis half bereits, Tiefenhirn-Elektroden genauer zu platzieren. Eines Tages aber könnten die Elektroden durch optogenetische Verfahren, die noch zielgenauer arbeiten, möglicherweise ganz ersetzt werden.
Ohnehin weist Deisseroth schon jetzt auf die langfristigen Implikationen der Technologie hin. "Ich verfasse zwar keine Artikel zu ethischen Fragen, aber sie gehen mir trotzdem jeden Tag durch den Kopf", sagt der Psychiater. "Wohin würde es führen, wenn man einst verstünde, was ein Wunsch, ein Bedürfnis, was Hoffnung ist – und man darüber sogar Kontrolle erlangen könnte?"
Gary Stix ist Redakteur bei Scientific American.
Dank der Optogenetik, welche die Genetik mit optischer Technik kombiniert (siehe Die Erleuchtung des Gehirns, SdW 5/2009), gewinnt Cricks Vision nun allmählich Gestalt. Seit einigen Jahren erst wird die neue Disziplin entwickelt, stößt aber schon auf breites Interesse, weil sie Wissenschaftler in die Lage versetzt, das Verhalten von Tieren zu manipulieren. So konnte eine Forschergruppe demonstrieren, dass Licht, eingestrahlt in das auf genetischem Weg ansteuerbar gemachte Gehirn von Mäusen, die Tiere dazu veranlasst, endlos im Kreis herumzulaufen.
Auch die Öffentlichkeit hat die Möglichkeit solcher Kunststücke bereits registriert und der US-Komiker und Moderator Jay Leno träumte schon 2006 von einer optogenetisch manipulierten Fliege, mittels derer sich George W. Bush nachhaltig drangsalieren ließe. Doch die Bedeutung der Optogenetik geht weit über ihre Verwendbarkeit in Comedy-Sendungen und pessimistischer Sciencefiction hinaus. Sie hat sich als wichtigste der neuen Technologien entwickelt, mittels derer wir die überwältigend komplexen Verschaltungen in den Gehirnen von Säugetieren besser verstehen können. Bereits jetzt liefert sie zum Beispiel Erkenntnisse über die Zusammenhänge zwischen "Fehlverdrahtungen" im Gehirn und neurologischen oder mentalen Störungen wie etwa der Parkinsonkrankheit und der Schizophrenie.
Gezielt an- und abschalten
Ein bahnbrechendes Experiment hatten Karl Deisseroth und seine Kollegen von der kalifornischen Stanford University und vom Frankfurter Max-Planck-Institut für Biophysik im Jahr 2005 durchgeführt. Das Team hatte gezeigt, wie sich ein Virus nutzen lässt, um ein Gen für das so genannte Kanalrhodopsin-2 – ein lichtempfindliches Protein – in spezifische Gruppen von Neuronen einzufügen. Sind die Neuronen einmal mit dieser aus Algen gewonnenen Bauanleitung ausgestattet und produzieren das Protein, feuern die Neuronen, sobald sie Lichtpulsen ausgesetzt werden. Dieses Experiment zeigte ebenso wie weitere, die bald folgten, dass sich ausgewählte Neuronen binnen weniger Millisekunden an- oder abschalten lassen, ohne dass Nachbarzellen davon betroffen wären. Hunderte von Labors weltweit haben Deisseroths Technik seither angewendet – und der im Jahr 2004 verstorbene Francis Crick hätte diesen Punkt auf seiner Wunschliste abhaken können
Der 38-jährige Psychiater Deisseroth, der einmal pro Woche weiterhin Patienten empfängt, hatte sich aus einem ganz besimmten Grund mit der Biotechnologie zu beschäftigen begonnen: Das vorhandene Instrumentarium, um mentale und neurodegenerative Störungen zu untersuchen und zu behandeln, schien ihm unzureichend. "Den Hirnstimulations-Behandlungen, die ich als Psychiater vielfach durchgeführt habe, mangelte es ganz erheblich an Präzision. Man kann zwar genau die Zellen stimulieren, die man stimulieren will, regt dabei gleichzeitig aber auch andere an", sagt er. Ähnliche Probleme bestehen mit Medikamenten, die ebenfalls (vergleichsweise) unspezifisch wirken.
Molekularer Zauberkasten
Mittlerweile hat Deisseroths Labor, zum Teil auch in Kooperation mit führenden Neurowissenschaftlern, einen "Werkzeugkasten" entwickelt, der auf Genen für das Kanalrhodopsin-2 und weiteren Opsinen beruht. Diese Proteine (für ihre Entdeckung und neurobiologische Anwendung wurde Ernst Bamberg vom MPI für Biophysik mit dem Wissenschaftspreis des Stifterverbands 2009 ausgezeichnet) fungieren als Poren oder Kanäle in der Zellmembran, welche sie – über eine Steuerung der Kanalweite – für bestimmte Ionen durchlässiger machen können. Auf diesem Weg lassen sich somit auch Neuronen an- oder ausschalten. Der molekulare Zauberkasten verhilft Forschern zu vielfältigen Fähigkeiten: Beispielsweise können sie nun ausschließlich eine Untergruppe eines bestimmten Zelltyps beeinflussen, oder eine Verschaltung zwischen zwei Gruppen ausgewählter Neutronen in unterschiedlichen Hirnregionen stimulieren, etwa im limbischen System und im Kortex. Zudem hat Deisseroth die Methoden verfeinert, mittels derer sich die Opsine in die Zellen einbringen lassen. Üblicherweise wird dabei ein Virus als Genfähre genutzt, die sowohl Opsin-Baupläne wie auch Regulatorsequenzen transportiert.
Stellen die Zellen schließlich Opsine her, muss man die Proteine nur noch aktivieren. Dazu verbindet Deisseroths Team Laserdioden mit winzigen Glasfaserkabeln und bringt diese in das Gehirns seiner Versuchstiere ein. Zusätzlich werden Elektroden implantiert, die das Feuern der Neuronen registrieren. Im vergangenen Jahr haben sich diese Techniken erheblich weiterentwickelt, sagt Deisseroth. "Zuvor waren sie ein interessantes und nützliches Tool für eine begrenzte Zahl von Anwendungen", so der Forscher, "nun aber lassen sie sich auf beliebige Zellen oder biologische Fragestellungen anwenden."
Kontrolle über Wünsche, Bedürfnisse, Hoffnungen?
Die überzeugendsten Experimente sind indessen jene, an denen die Relevanz der Optogenetik sowohl für die Grundlagenforschung als auch die Medizin deutlich wird. Eines davon stellte Michael Häusser vom University College London im letzten Oktober vor, als sich die internationale Society for Neuroscience in Chicago traf. 100 Neuronen, so hatte sein Team nachgewiesen, konnten eine Erinnerung auslösen, die in einem viel größeren Ensemble von etwa 100 000 Neuronen gespeichert war. Offenbar lässt sich diese Technik auch nutzen, um die Bildung von Gedächtnisinhalten zu untersuchen.
Eine optogenetische Studie, die Deisseroths Gruppe in Frühjahr 2009 veröffentlicht hatte, half auch bei der Aufklärung der Funktionsweise von Tiefenhirnstimulationen, die durch das Implantieren von Elektronen im Gehirn das für Parkinson typische Zittern lindern können. Üblicherweise wird diese Wirkung durch die Aktivierung des so genannten subthalamischen Kerns im Zwischenhirn erklärt. Nun aber scheint sich herauszustellen, dass die Elektroden ihre Wirkung auf Nervenfasern ausüben, die vom Motorcortex und möglicherweise weiteren Gehirnregionen in den subthalamischen Kerns gelangen. Diese Erkenntnis half bereits, Tiefenhirn-Elektroden genauer zu platzieren. Eines Tages aber könnten die Elektroden durch optogenetische Verfahren, die noch zielgenauer arbeiten, möglicherweise ganz ersetzt werden.
Ohnehin weist Deisseroth schon jetzt auf die langfristigen Implikationen der Technologie hin. "Ich verfasse zwar keine Artikel zu ethischen Fragen, aber sie gehen mir trotzdem jeden Tag durch den Kopf", sagt der Psychiater. "Wohin würde es führen, wenn man einst verstünde, was ein Wunsch, ein Bedürfnis, was Hoffnung ist – und man darüber sogar Kontrolle erlangen könnte?"
Gary Stix ist Redakteur bei Scientific American.

Schreiben Sie uns!
Beitrag schreiben