Lexikon der Biochemie: Calmodulin
Calmodulin, calciumabhängiges Regulatorprotein, CDR (engl. calcium dependent regulator), Calcium-Modulator, CaM, ein aus 148 Aminosäuren aufgebautes Protein (Mr 17kDa) mit vier Bindungsstellen für Ca2+-Ionen. C. ist der wichtigste Vertreter der Calcium-bindenden Proteine und kommt in tierischen und pflanzlichen Zellen als weitverbreiteter intrazellulärer Ca2+-Rezeptor vor, der eine Vielzahl Ca2+-regulierter Prozesse vermittelt. Bei Anstieg des cytoplasmatischen Calciumspiegels über 500 nM, verursacht durch Öffnung von Calciumkanälen in der Plasmamembran oder einer Membran von intrazellulären Speichervesikeln, wird C. durch die Bindung von drei oder vier Ca2+-Ionen aktiviert. Viele Enzyme, Pumpen, Membrantransportproteine und andere Zielproteine werden durch Ca2+/CaM reguliert, wobei die meisten Wirkungen nicht direkt durch C., sondern über Ca2+/CaM-abhängige Protein-Kinasen ausgelöst werden. Repräsentative Beispiele hiefür sind die calmodulinabhängige Protein-Kinase II, kurz CaM-Kinase II genannt, und die Ca2+-ATPase-Pumpe der Plasmamembran (Ca2+-ATPasen). In einer Säugerzelle sind mehr als 107 Moleküle C. enthalten. In einigen Fällen ist C. auch eine selbständige regulatorische Untereinheit eines allosterischen Enzyms (z.B. Phosphorylase-Kinase). C. ist aus zwei globulären Strukturelementen aufgebaut, die über eine lange α-Helix miteinander verknüpft sind, und zusammen 6,5nm lang sind. Beide globulären Enden enthalten je zwei Schleifen aus 12 Aminosäureresten für die Bindung der Ca2+-Ionen (Abb.). Interessanterweise haben die beiden Ca2+-Bindungsregionen am C-Terminus eine etwa zehnfach höhere Affinität zu Ca2+ als die beiden anderen Bindungsstellen im N-terminalen Bereich. C. erkennt die verschiedenen Zielproteine offenbar an positiv geladenen, amphipathischen α-Helices, da beide Lappen des Ca2+-C. hydrophobe Sequenzbereiche aufweisen, die von negativ geladenen Regionen umgeben sind, und damit Komplementarität zu positiv geladenen amphiphilen α-Helices aufweisen. [P. Cohen u. C.B. Klee (Hrsg.) Calmodulin. Elsevier, Amsterdam, 1988]
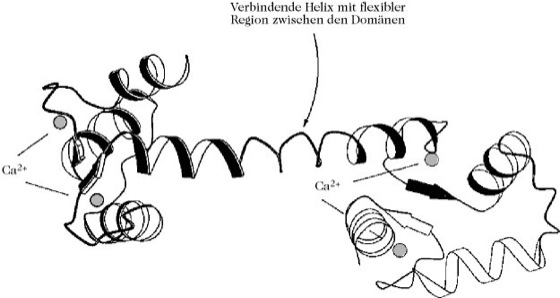
Calmodulin. Struktur des Calmodulins.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.