Lexikon der Biochemie: Festphasen-Peptidsynthese
Festphasen-Peptidsynthese, SPPS (engl. solid phase peptide synthesis), Merrifield-Synthese, eine 1962 vom Nobelpreisträger Robert Bruce Merrifield eingeführte Peptidsynthese, bei der ein unlöslicher polymerer Träger verwendet wird. Ein lineares Peptid wird durch schrittweises Anknüpfen der sequenzspezifischen, temporär geschützten Aminosäuren aufgebaut, wobei das C-terminale Ende der wachsenden Polypeptidkette kovalent mit einem Kunstharzträger verknüpft ist (Abb. 1). Zur Gewährleistung einer kontrollierten Reaktionsführung und zur Vermeidung von Nebenreaktionen müssen reaktive funktionelle Seitenketten der Aminosäuren durch geeignete Schutzgruppen temporär blockiert werden. Während die α-Aminogruppe der zu verknüpfenden Aminosäure nur bei der eigentlichen Kupplungsreaktion geschützt sein muss, werden permanente Seitenkettenschutzgruppen erst nach Beendigung der Synthese vom Peptid abgespalten. Im Gegensatz zur ribosomalen Proteinbiosynthese erfolgt die Verlängerung der Peptidkette vom C- zum N-Terminus. Als polymerer Träger hat sich ein Copolymerisat aus Polystyrol und 1-2% 1,4-Divinylbenzol bewährt. Die durch Perlpolymerisation erhaltenen Harzkügelchen mit einem Durchmesser zwischen 20 und 100 μm quellen in den für die Synthese verwendeten Lösungsmitteln und werden dadurch für die Reagenzien permeabel. Als intermediäre α-Aminoschutzgruppen werden hauptsächlich die tert.-Butyloxycarbonyl (Boc)- und die Fluorenyl-9-methoxycarbonyl (Fmoc)-Gruppe eingesetzt. Die Boc-Gruppe ist stabil gegenüber katalytischer Hydrierung und alkalischer Hydrolyse und lässt sich durch milde Acidolyse, z. B. mit Trifluoressigsäure (TFA) abspalten. Die ständige Wiederholung der sauren Deblockierungsreaktionen nach den einzelnen Kupplungsschritten kann zur partiellen Deblockierung von Seitenkettenschutzgruppen sowie zu einer geringen Hydrolyse der Ankerbindung zum polymeren Träger führen. Die Fmoc-Gruppe (Abb. 1) besitzt den Vorteil, dass sie durch Behandlung mit geeigneten Basen wie Morpholin, 2-Aminoethanol oder Piperidin abgespalten werden kann. Werden als Ankergruppierung am polymeren Träger sowie zum Schutz der Drittfunktionen entsprechender Aminosäurebausteine säurelabile, gegen Basen resistente Gruppierungen verwendet, dann können vorteilhafterweise intermediäre und permanente Schutzgruppen unabhängig voneinander abgespalten werden.
Die Kupplungsreaktion (3) ist ein äußerst wichtiger Schritt für die F., weil ein vollständiger Umsatz die Grundvoraussetzung für die Einheitlichkeit des Endprodukts ist. In der Regel wird das Reagens im Überschuss eingesetzt, wobei Anhydride, Aktivester oder sog. in-situ-Aktivatoren, bei denen intermediär aktivierte Esterderivate entstehen, bevorzugte Verwendung finden. Die sich ständig wiederholenden Reaktionsschritte (2) Abspaltung der α-Aminoschutzgruppe und (3) Anknüpfung der nächsten Nα-geschützten Aminosäure (Kupplungsreaktion) haben die weitgehende Automatisierung der Syntheseschritte und Konstruktion von Peptidsynthesizern (Abb. 2) ermöglicht, von denen die meisten nach dem Durchflussprinzip arbeiten. Das Harz befindet sich in einer Säule mit einer Fritte am Boden, so dass Reagenzien und Lösungsmittel automatisch zugeführt, mit dem Trägermaterial vermischt und anschließend abgesaugt werden können. Die Wiederholung der Schritte 2 und 3 erfolgt bis zur gewünschten Länge des aufzubauenden Peptids. Im Schritt 5 erfolgt die Abspaltung des synthetisierten Peptids vom polymeren Träger. Die Ablösung von der Harzmatrix gelingt mittels Reagenzien, die in Abhängigkeit vom gewählten Schutzgruppenschema die Ankerbindung zwischen C-terminaler Aminosäure und Träger selektiv spalten, oder auch synchron eine partielle oder vollständige Deblockierung des synthetisierten Peptids bewirken. Aus der F. entwickelte sich die multiple Peptidsynthese. [E. Atherton u. R.C. Sheppard Solid-Phase Synthesis – A Practical Approach, Oxford University Press, 1989; H.-D. Jakubke Peptide: Chemie und Biologie, Spektrum Akademischer Verlag Heidelberg, 1996]
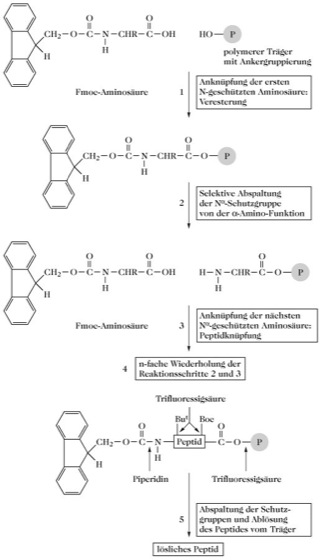
Abb. 1. Festphasen-Peptidsynthese. Schematische Darstellung der Festphasen-Peptidsynthese unter Anwendung des Fmoc, But-Schutzgruppenschemas.
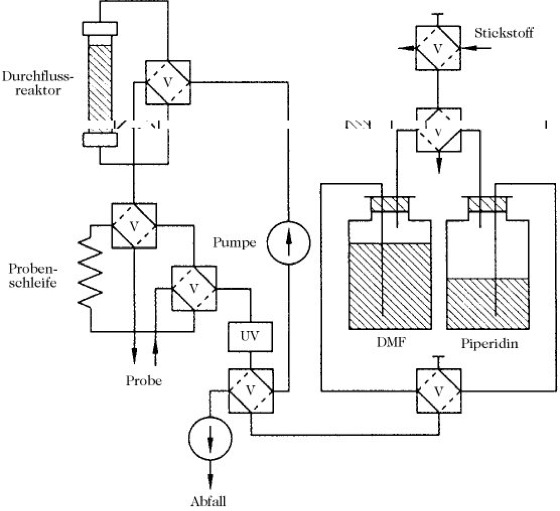
Abb. 2. Festphasen-Peptidsynthese. Schematische Darstellung eines Peptidsynthesizers. V = Ventil, UV = UV-Detektor, DMF = Dimethylformamid.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.