Lexikon der Biologie: Markierung
Markierung, label, labelling. 1) Biochemie und Molekularbiologie: Techniken zur Lokalisierung oder Identifizierung von bestimmten Molekülen, wie z.B. DNA-Fragmenten oder Proteinen. Oft angewandt wird die radioaktive Markierung von DNA-Fragmenten mit instabilen Isotopen durch enzymatische Reaktionen, wobei die Struktur der markierten und unmarkierten Fragmente identisch ist. Beispiele sind die Phosphorylierung der 5'-Termini unter Verwendung von γ-32P-ATP und Polynucleotid-Kinase, das Auffüllen von sticky ends mit α-32P-dNTPs und Klenow-Enzym (Endmarkierung von DNA-Fragmenten, Klenow-Fragment) oder interne Markierungen mittels nick translation, random priming, Polymerase-Kettenreaktion oder reverse Transkription (reverse Transkriptase). Auch Peptide und Proteine können mit radioaktiven Isotopen markiert werden, z.B. durch Phosphorylierung mit 32P, durch Einführung von 125I und 131I (Iod) mittels elektrophiler Addition sowie durch Einbau von 14C (Kohlenstoff) und 3H (Tritium) in Form von Acetylgruppen und Alkylgruppen oder in Form radioaktiver Aminosäuren in in-vitro-Translationssystemen. Die Detektion radioaktiv markierter Verbindungen erfolgt durch Autoradiographie, Fluorographie und im Szintillationszähler. Neben der radioaktiven Markierung von Molekülen mit Isotopen gewinnen immer mehr nicht-radioaktive Techniken an Bedeutung. Zur Markierung von DNA-Fragmenten werden einzubauende Nucleotide modifiziert und damit deren chemische Struktur verändert. Beispielsweise können Biotin oder Digoxigenin (Digitalisglykoside) über Linker bzw. spacer an dUTP ( vgl. Abb. 1 ), dCTP oder dATP gekoppelt werden. Der Nachweis der so markierten Moleküle erfolgt durch Biotin- oder Digoxigenin-spezifische Antikörper (oder Streptavidin bzw. Avidin bei Biotin), welche entweder mit fluoreszierenden/lumineszierenden (Fluoreszenz, Lumineszenz) Reportergruppen oder aber mit Reporterenzymen (z.B. alkalische Phosphatase oder Meerrettich-Peroxidase) gekoppelt sind ( vgl. Abb. 2 ), die bestimmte zugesetzte Chemikalien umsetzen (indirekte Reportersysteme). Im Falle der alkalischen Phosphatase als Reporterenzym kommt z.B. häufig das BCIP/NBT-System ( vgl. Abb. 3 ) zum Einsatz, wobei ein blauviolettes Präzipitat entsteht, das direkt sichtbar ist. Verwendet man AMPPD oder CSPD® als Substrate, wird Licht emittiert, das nach Auflegen von Filmen nachweisbar ist (Chemilumineszenz). Im Fall der Fluoreszenzmarkierung sind an die Antikörper Fluorochrome als Reportergruppen gebunden (Immunfluoreszenz). Nicht-radioaktive Markierungstechniken sind u.a. bei den verschiedenen blotting-Techniken, der Kolonie-Hybridisierung oder beim recognition-site-screening anwendbar. Je nach Untersuchungsobjekt oder Fragestellung kann die Markierung auch ohne Biotin oder Digoxigenin durch direkte Kopplung mit Reportergruppen bzw. Reporterenzymen geschehen (direkte Reportersysteme). Zur Markierung von Proteinen können prinzipiell ähnliche Methoden angewandt werden, wobei hier seltener im eigentlichen Sinne markiert, sondern häufiger unter Verwendung Protein-spezifischer Antikörper und entsprechender Reportersysteme detektiert wird. – Eine nicht-radioaktive Markierung kann außerdem mit Hilfe photoreaktiver Substanzen erfolgen, die nach Bestrahlung kovalente Bindungen eingehen. Bei DNA sind dies z.B. interkalierende Photosensibilisatoren wie Psoralen oder Acridinorange, bei Proteinen Verbindungen mit Arylazid-, Diazirin- oder Benzophenongruppen (Photoaffinitätsmarkierung). Affinitätsmarkierung, Austauschmarkierung, Ferritinmarkierung, Fremdmarkierung, Goldmarkierung, Indikator, indirekte Endmarkierung, Marker, Protein-A-Gold-Markierung, Pulsmarkierung, Sequenzierung; Replikation der DNA I. 2) Zoologie: a) Kennzeichnung von Tieren durch den Menschen zur Wiedererkennung einzelner Individuen; markiert wird z.B. mit Ringen (bei Vögeln, Beringung), Ohrkerben, Zehenamputationen, Färbung oder Mikrosendern (bei Säugetieren), Plastikmarken (bei Fischen), Papiermarken oder Farbtupfer (bei Fischen, Insekten); dient z.B. der Untersuchung von Wanderungsverhalten und Lebensalter; Nutztiere werden zum Teil mit Brandzeichen zur Eigentumskennzeichnung markiert. b) Ethologie: Markierverhalten.
E.G./M.B.

Markierung
Abb. 1:Digoxigenin-11-dUTP wird zur nicht radioaktiven Markierung von DNA-Fragmenten eingesetzt.
Markierung
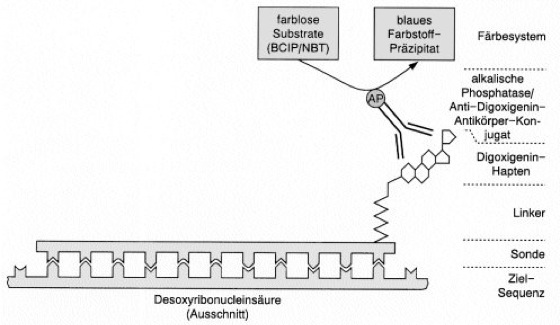
Abb. 2: Schema zum Nachweis nicht-radioaktiv markierter DNA mit spezifischen Antikörpern, die mit Enzymen (hier alkalische Phosphatase) konjugiert sind. Nach Hybridisierung der Sonde (markiertes DNA-Fragment) an die Ziel-Sequenz, z.B. bei der Southern-Technik, bindet ein spezifischer Antikörper an den Digoxigenin-Anteil der Markierung. Zugesetzte Substrate werden von dem angehängten Enzym umgesetzt und führen am Ort ihrer Entstehung zu einem blauen Niederschlag, der den Ort der Sonde und somit der gesuchten Zielsequenz anzeigt.
Markierung
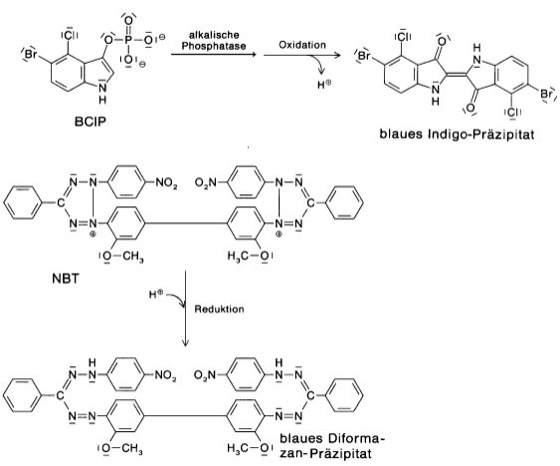
Abb. 3: Bei Verwendung des BCIP/NBT-Färbesystems fällt nach Abspaltung der Phosphat-Gruppe von BCIP (5-Bromo-4-chloro-3-indolylphosphat) und Oxidation ein blauer Indigo-Farbstoff am Entstehungsort aus. Der Farbverstärker NBT (Nitroblau-Tetrazoliumchlorid) wandelt sich unter Aufnahme des entstandenen Protons in ein ebenfalls blaues Diformazan um.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.