Lexikon der Chemie: Acetylenchemie
Acetylenchemie, Sammelbegriff für alle vom Ethin (Acetylen) ausgehenden chem. Reaktionen. Ethin ist die Grundsubstanz sehr vieler organischer Verbindungen, so daß es neben dem Erdöl und der Kohle Träger der modernen organischen chem. Großindustrie geworden ist. So lassen sich Acetaldehyd und seine Folgeprodukte, wie Essigsäure, Ethylacetat, Essigsäureanhydrid, Aceton, Ethanol, Crotonaldehyd und Butanol, aus Ethin herstellen.
Der technisch außerordentlich wichtige moderne Teil der A. wird nach seinem Begründer W. Reppe als Reppe-Chemie bezeichnet. Reppe hat durch die Einführung der Drucksynthese ein neues Gebiet der A. erschlossen. Die Explosionsgefahr des komprimierten Ethins wurde von ihm durch sorgfältige Betriebsführung ausgeschlossen. Von besonderer Bedeutung sind folgende Reaktionen:
1) die Hydratisierung des Ethins führt in Gegenwart von 15%iger Schwefelsäure mit Quecksilber(II)-sulfat als Katalysator zu Acetaldehyd, dem wichtigsten Zwischenprodukt der A.: HC≡CH + H2O → CH3-CHO.
Beim Einsatz Homologer des Ethins bilden sich Ketone.
2) Die katalytische Hydrierung des Ethins und seiner Homologen führt entweder bis zum entsprechenden Alkan, oder die C≡C-Dreifachbindungen können mit desaktivierten Katalysatoren selektiv in C=C-Doppelbindungen übergeführt werden. Dazu wird ein mit Blei(II)-acetat vergifteter Palladium-Calciumcarbonat-Katalysator verwendet. Die Wasserstoffübertragung erfolgt dabei als cis-Addition. Doppelbindungen werden bei diesem Verfahren nicht angegriffen:
R-C≡C-CH=CH-R + H2 → R-CH=CH-CH=CH-R.
Eine selektive Hydrierung zum Alken ist auch mit Natrium in flüssigem Ammoniak möglich, wobei trans-Addition beobachtet wird.
3) Die Anlagerung von Halogenen, z. B. Chlor oder Brom, kann durch Lewis-Säuren beschleunigt oder durch Licht initiiert werden, sie verläuft stereoselektiv als trans-Addition zu 1,2-disubstituierten Ethenen und bei weiterer Zugabe zu 1,1,2,2-Tetrahalogenethan, das unter Abspaltung von Halogenwasserstoff in Trihalogenethen übergeht.
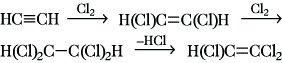
Trichlorethen ist ein wichtiges Lösungsmittel.
4) Bei der Dimerisation des Ethins bildet sich bei Verwendung von Ammonium- und Kupfer(I)-chlorid als Katalysator Vinylethin, das Ausgangsprodukt für Chloropren: CH2=CCl-CH=CH2.
Als Reppe-Synthesen werden bezeichnet:
5) Vinylierung. Ethine addieren neben Halogenwasserstoffen und Wasser auch Alkohole, Phenole, Thiole, Amine, Carbonsäuren und Blausäure unter Bildung verschiedenartiger Vinylverbindungen. a) Die Addition von Chlorwasserstoff an Ethin in Gegenwart eines Quecksilber(II)-chlorid/Aktivkohle-Katalysators gemäß HC≡CH + HCl → CH2=CHCl führt zu Vinylchlorid, das zur Herstellung von Polyvinylchlorid (PVC) benötigt wird. b) Durch Addition von Essigsäure an Ethin in Anwesenheit eines Zinkacetat/Aktivkohle- oder Quecksilber(II)-chlorid-Katalysators entsteht Vinylacetat: CH≡CH + CH3COOH → CH2=CH-OOCCH3. c) Die Anlagerung von Blausäure führt zu Acrylnitril: HC≡CH + HCN → H2C=CH-CN. d) Durch Anlagerung von Alkoholen an Ethin bei Anwendung alkalisch wirkender Katalysatoren entstehen Vinylether: HC≡CH + ROH → H2C=CH-OR.
6) Ethinylierungen sind Reaktionen des Ethins mit Aldehyden oder Ketonen unter Aufrechterhaltung der Dreifachbindung. Als Katalysatoren wirken Kupfer(I)-Salze, auch Kupferacetylid. Von technischer Bedeutung sind die Reaktionen von Ethin mit Formaldehyd zu Propargylalkohol und But-2-in-1,4-diol, aus dem nach Hydrierung Butan-1,4-diol zugänglich ist und von Ethin mit Aceton zu 3-Methyl-but-1-in-3-ol.
7) Bei Carbonylierungen werden Ethin und Kohlenmonoxid in Gegenwart von Wasser, Alkohol und sekundären Aminen, zu Acrylsäure oder Acrylsäurederivaten umgesetzt: HC≡CH + CO + H2O → CH2=CH-COOH (Acrylsäure), HC≡CH + CO + ROH → CH2=CH-COOR (Acrylsäureester), HC≡CH + CO + R2NH → CH2=CH-CONR2 (Acrylsäureamid). Die Carbonylierung verläuft unter Druck und dem katalytischen Einfluß carbonylbildender Metalle, wie Cobalt, Nickel und Eisen.
8) Die Cyclisierung des Ethins in Gegenwart von Tricarbonyl(triphenylphosphin)nickel ergibt ein Gemisch von Benzol (88 %) und Styrol (12 %). In Gegenwart von Nickel(II)-cyanid und Tetrahydrofuran wird neben anderen Produkten das damit technisch zugängliche Cyclooctatetraen zu 70 % erhalten.
Während die Reaktionen 1 bis 3 und 5c) als unwirtschaftlich gelten, stellt man Vinylether heute ausschließlich aus Ethin her, und die Synthese von Butin-1,4- bzw. Butan-1,4-diol aus Ethin ist konkurrenzlos.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.