Lexikon der Chemie: Dicarbonsäuren
Dicarbonsäuren, organische Verbindungen, die zwei Carboxygruppen im Molekül enthalten. Entsprechend der organischen Stammverbindung unterscheidet man die auch in der Natur weit verbreiteten aliphatischen D., die aromatischen D. und die weniger bekannten heterocyclischen D.
Dicarbonsäuren. Tab. Wichtige Beispiele.
| ||||
| Oxalsäure | Ethandisäure | HOOC-COOH | 101,5 | |
| Malonsäure | Propandisäure | HOOC-CH2-COOH | 135,6 | |
| Bernsteinsäure | Butandisäure | HOOC-(CH2)2-COOH | 188 | |
| Glutarsäure | Pentandisäure | HOOC-(CH2)3-COOH | 99 | |
| Adipinsäure | Hexandisäure | HOOC-(CH2)4-COOH | 153 | |
| Pimelinsäure | Heptandisäure | HOOC-(CH2)5-COOH | 106 | |
| Korksäure | Octandisäure | HOOC-(CH2)6-COOH | 144 | |
| Azelainsäure | Nonandisäure | HOOC-(CH2)7-COOH | 106,5 | |
| Sebacinsäure | Decandisäure | HOOC-(CH2)8-COOH | 134,5 | |
| – | Undecandisäure | HOOC-(CH2)9-COOH | 111 |
Nomenklatur. Die systematische Bezeichnung der aliphatischen D., zu denen auch zahlreiche ungesättigte Verbindungen zählen, wird aus dem Namen des aliphatischen Kohlenwasserstoffes und der Endung -disäure gebildet, z. B. Ethandisäure HOOC-COOH, Propandisäure HOOC-CH2-COOH und (Z)- oder (E)-Butendisäure HOOC-CH=CH-COOH. Bekannter sind die auf ihre Herkunft aus dem Pflanzen- oder Tierreich hinweisenden Trivialnamen, z. B. Oxalsäure, Malonsäure und Maleinsäure oder Fumarsäure. Die systematischen Namen der aromatischen und heterocyclischen D. werden aus den Bezeichnungen der entsprechenden Stammverbindungen und der Endung -dicarbonsäure gebildet:

Eigenschaften. D. sind kristalline, meist farblose Verbindungen. Die niederen Vertreter lösen sich teilweise sehr gut in Wasser, mit steigender Molekülmasse nimmt die Löslichkeit stark ab. Die Schmelzpunkte der gesättigten aliphatischen D. alternieren ähnlich wie die der Alkane und der Monocarbonsäuren; geradzahlige D. schmelzen bei höherer Temperatur als die ungeradzahligen, benachbarten D.
D. sind aufgrund ihrer Struktur in der Lage, durch Dissoziation zwei Protonen stufenweise abzuspalten. Dabei erfolgt der erste Schritt wesentlich leichter als der zweite, da das primär gebildete Carboxylat-Anion die Dissoziation des zweiten Protons erschwert. In der ersten Dissoziationsstufe sind D. stärker als die unsubstituierten Monocarbonsäuren, ausgenommen die Ameisensäure, die ihrerseits nur von der Oxalsäure und der Malonsäure übertroffen wird. Bei längerkettigen D. beeinflussen sich die Carboxygruppen bezüglich ihres Säurecharakters nur noch unwesentlich.
Reaktionen. D. reagieren im wesentlichen wie die Monocarbonsäuren, wobei die Carboxygruppen gleichzeitig oder auch nacheinander zur Reaktion gebracht werden können. Auf diese Weise sind eine Reihe saurer oder neutraler funktioneller Derivate zugänglich.
Bei der thermolytischen Abwandlung in der homologen Reihe der aliphatischen D. kann folgende Regelmäßigkeit beobachtet werden: Oxalsäure bzw. Malonsäure decarboxylieren beim Erhitzen auf etwa 200 °C bzw. 150 °C unter Bildung von Ameisensäure bzw. Essigsäure. Aus den nächsthöheren Vertretern, Bernsteinsäure und Glutarsäure, entstehen unter Wasserabspaltung cyclische Anhydride:
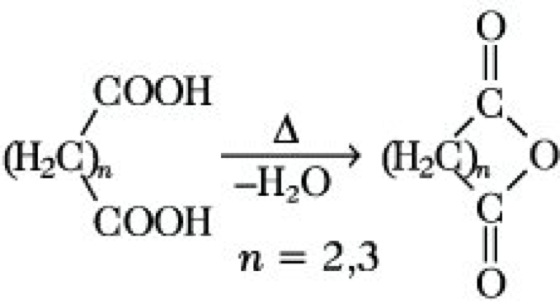
Ähnlich reagieren auch Maleinsäure und Phthalsäure. Aus Adipin-, Pimelin- und Korksäure können beim Erhitzen auf etwa 300 °C unter Wasser- und Kohlendioxidabspaltung die entsprechenden, um ein C-Atom ärmeren Cycloalkanone erhalten werden Durch Thermolyse der Erdalkali- oder Thoriumsalze können auch die höheren Homologen der D. in cyclische Ketone übergeführt werden. Die Synthese der aliphatischen D. erfolgt hauptsächlich durch Hydrolyse von Dinitrilen, durch Oxidation von Diolen oder durch die Malonestersynthese, aromatische D. können unter anderem durch Oxidation dimethylsubstituierter Aromaten erhalten werden.
Verwendung. D., ihre Substitutionsprodukte und Derivate werden vorwiegend als Synthesebausteine für Polymere, z. B. Polyester- bzw. Polyamidfasern, verwendet.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.