Lexikon der Chemie: Elektrophorese
Elektrophorese, im weiteren Sinne die Trennung von geladenen Teilchen einer Lösung aufgrund ihrer unterschiedlichen Wanderungsgeschwindigkeit in einem elektrischen Feld ohne Abscheidung an den Elektroden. Die Wanderungsgeschwindigkeit v ist das Produkt aus der Feldstärke E und der Nettobeweglichkeit m der Ionen: v = m·E. Verbindet man zwei Elektroden durch einen kontinuierlich leitenden Elektrolyten miteinander (elektrophoretisches System), so ist die Feldstärke innerhalb des Systems konstant und folglich die Wanderungsgeschwindigkeit proportional der Nettobeweglichkeit. Da diese unter definierten elektrophoretischen Bedingungen von Größe, Gestalt und Ladung der Teilchen abhängt, kann man Teilchen verschiedener Art voneinander trennen. Als E. im engeren Sinne bezeichnet man die Wanderung von Kolloidteilchen oder Makromolekülen, als Ionophorese die Bewegung kleiner anorganischer Ionen. Der Wanderung der Teilchen im elektrischen Feld wirkt die Diffusion entgegen, deren Einfluß der Teilchengröße und der Feldstärke proportional ist. Folglich erfordert die Trennung kleiner Ionen große Spannungen (1000 bis 10000 V), während sich große Teilchen durch Niederspannungselektrophorese (300 bis 400 V) trennen lassen. Die Wanderungsgeschwindigkeit der Ionen zeigt weiterhin eine große Abhängigkeit vom Dissoziationsgrad und damit vom pH-Wert der Lösung. Bei Vorzeichenumkehr der Ladung der Teilchen infolge pH-Änderung verändert sich die Wanderungsrichtung. Für jede Substanz existiert ein isoelektrischer Punkt, an dem die Beweglichkeit des Teilchens Null wird. Durch geeignete Pufferwahl zur Einstellung der Beweglichkeit und Löslichkeit der Stoffe kann die E. dem jeweiligen Trennproblem angepaßt werden.
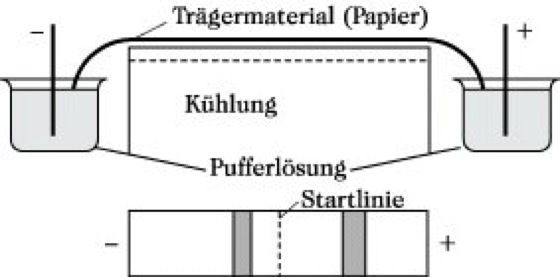
Elektrophorese. Abb.: Elektrophoreseapparatur und Elektropherogramm.
Die E. kann in freier Lösung oder auf Trägermaterialien, wie Stärke, PVC-Pulver, Cellulose (Papier), Polyamid-Agarose- und Dextrangel, durchgeführt werden (Elektropherographie, Elektrochromatographie), auf denen elektrophoretische mit chromatographischen Trennprinzipien kombiniert sind. So werden bei der Gelelektrophorese die geladenen Moleküle mit Hilfe eines elektrischen Feldes in einer Pufferlösung durch ein poröses Gel getrieben. Variation in Gelzusammensetzung und Puffer gestatten, die Moleküle sowohl entsprechend ihrer Ladung, ihrem isoelektrischen Punkt, ihrer Nettobeweglichkeit (Isotachophorese) oder auch entsprechend ihrer biospezifischen Affinität (Affinoelektrophorese) zu trennen. Bei der Porengradientenelektrophorese nimmt die Porengröße des Gels in Richtung der elektrophoretischen Beweglichkeit kontinuierlich ab, so daß Moleküle (z. B. natürliche Proteine) vorrangig nach ihrer Größe getrennt werden. Das bei der Diskelektrophorese verwendete Gel besitzt Diskontinuitäten im pH-Wert und in der Porengröße, die aus der Kombination eines großporigen Sammelgels zur Konzentrierung der Probe auf eine schmale Startzone und eines feinporigen Trenngels (Permeationseffekt) für die Fraktionierung der Komponenten resultieren, wodurch eine große Trennleistung bedingt wird. Bei der SDS-Elektrophorese bindet als Detergens zugesetztes Natriumdodecylsulfat (SDS) die Moleküle der Analysenprobe, wobei es ihre natürliche Ladung mit seiner eigenen negativen Ladung maskiert. Die nun in ihrer Ladungsdichte gleichen Moleküle werden nach ihrer Größe durch die Permeationseffekte des Gels getrennt.
Technik der E. Sehr verbreitet ist die Papierelektrophorese, wobei die Elektrophoresekammer aus zwei Elektrodenkammern und einer erhöhten Auflage für den planliegenden Träger besteht. In Abhängigkeit von ihrer voraussichtlichen Wanderungsrichtung wird die Probe punkt- oder streifenförmig auf den Träger aufgetragen (Abb.). Die qualitative und quantitative Auswertung der Elektropherogramme erfolgt analog der Dünnschicht- bzw. Papierchromatographie.
Anwendung. Die E. kann zur Trennung geladener, in wäßrigen Lösungen stabiler Teilchen angewendet werden, z. B. in der Routineuntersuchung biologischer Flüssigkeiten (Urin, Serum), zur Fraktionierung von Nucleinsäuren, zur Charakterisierung von Enzymen oder zur Ermittlung von Moleküleigenschaften (isoelektrischer Punkt, elektrophoretische Beweglichkeit, Molekülmasse).
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.