Lexikon der Chemie: Elementaranalyse
Elementaranalyse, Gesamtheit der Verfahren zur Ermittlung der Bruttoformel einer organischen Verbindung. Man unterscheidet die qualitative E. und die quantitative E.
1) Qualitative E.Diese wird der quantitativen E. gegebenenfalls als Vorprobe vorangestellt. Zum Nachweis von Kohlenstoff und Wasserstoff erhitzt man die Probe mit gepulvertem Kupferoxid. Das dabei entstehende Kohlendioxid wird in Barytwasser geleitet und fällt daraus Bariumcarbonat. Wasserstoff erkennt man durch die Bildung von Wassertröpfchen an kühleren Stellen der Apparatur. Stickstoff, Schwefel und Halogene, die neben Kohlenstoff, Wasserstoff und Sauerstoff bevorzugt am Aufbau organischer Moleküle beteiligt sind, weist man nach, indem man eine kleine Probe der Untersuchungssubstanz zusammen mit einem erbsengroßen Stück Natrium (oder Kalium) in einem zugeschmolzenen Reagenzgläschen bis zur Rotglut erhitzt und in ein Becherglas mit kaltem, destilliertem Wasser wirft. Dabei zerspringt das Reagenzgläschen, und die Reaktionsprodukte gehen in Lösung. In einem Teil dieser Aufschlußlösung wird der in Natriumcyanid übergeführte Stickstoff nach der Lassaigne-Vorprobe nachgewiesen. In weiteren Teilen der Aufschlußlösung werden Schwefel als Bleisulfid sowie die Halogene in Form ihrer Silbersalze nachgewiesen. Eine andere Vorprobe für Halogene stellt der Beilstein-Test dar.
2) Quantitative E.Von ungleich größerer Bedeutung ist die auf Liebig zurückgehende quantitative E. In ihrem Verlauf werden sämtliche kovalenten Bindungen des organischen Moleküls aufgespalten, und die am Molekülaufbau beteiligten Elemente werden quantitativ in einheitliche, nach ihrer Menge meßbare, anorganische Stoffe übergeführt (Mineralisierung der organischen Substanz), meist durch Verbrennen der Probe. Die festgestellten Mengen der Verbrennungsprodukte werden unter Berücksichtigung bestimmter Umrechnungsfaktoren ins Verhältnis zur eingewogenen Probenmenge gesetzt und ergeben nach Multiplikation mit 100 % den prozentualen Masseanteil der entsprechenden Elemente. Das Ergebnis einer E. ist z. B.: 52,15 % C; 4,42 % H; 20,32 % N; 23,17 % O. Man dividiert durch die jeweiligen Atommassen:
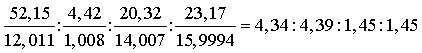
Unter Beachtung der Fehlergrenzen der Bestimmungen leitet man anschließend aus diesen Werten das ganzzahlige Atomzahlverhältnis der Elemente ab und stellt die Verhältnisformel der Probe auf: (C3H3NO)x. Durch eine gesondert ausgeführte Molekülmasse- (Molekulargewichts-) Bestimmung muß der Zahlenwert für x mittelt werden. Ergibt die Molekülmassebestimmung z. B. M = 138,3 g mol-1, dann lautet die Summenformel der untersuchten Probe C6H6N2O2. Die quantitative E. wird heute größtenteils im Mikromaßstab durchgeführt. Die wichtigsten Methoden sind folgende:
a) Bestimmung von Kohlenstoff und Wasserstoff 2 bis 4 mg der Probe werden in einem Quarzrohr im Sauerstoffstrom verbrannt. Zur Vervollständigung der Oxidation werden meist in den vorderen Teil des Rohres Oxidationskatalysatoren eingebracht (Kupfer(II)-oxid, Cobalt(II,IV)-oxid u. a.). Störende Verbrennungsprodukte, wie Schwefeldioxid, Halogene und Stickoxide, werden an geeigneten Absorptionsmitteln zurückgehalten. Die Endbestimmung der verbleibenden Verbrennungsprodukte Kohlendioxid und Wasser erfolgt meist gravimetrisch durch Absorption an Magnesiumperchlorat oder Natriumhydroxid (Ascarites) auf Träger. Die Absorptionsmittel befinden sich in speziellen Absorptionsröhrchen, die vor und nach der Verbrennung gewogen werden. In neuerer Zeit werden zunehmend gaschromatographische Trennung der Verbrennungsprodukte und ihre Bestimmung über Wärmeleitfähigkeit, IR-Photometrie oder andere physikochem. Methoden kombiniert. Dadurch sinkt der Zeitaufwand erheblich, und eine Reihe von Fehlereinflüssen wird ausgeschaltet; die durchgreifende Automatisierung des Analysenprozesses im Analyzer wird möglich.
b) Bestimmung des Sauerstoffs. Sie gehört zu den wenig erschlossenen Methoden in der E. Oft wird daher aus der Differenz aller übrigen ermittelten Gehalte zu 100 % auf den Sauerstoffgehalt extrapoliert. Eine Direktbestimmung ist durch "Cracken" der organischen Substanz im Stickstoffstrom möglich. Dabei wird an einem auf 900 bis 1100 °C erhitzten Kohlekontakt der Sauerstoff quantitativ in Kohlenmonoxid übergeführt.
c) Bestimmung des Stickstoffs. Dazu wird die organische Substanz nach der Dumas-Methode thermisch zersetzt. Nach der Kjeldahlschen Stickstoffbestimmung können manche Substanzen mit Schwefelsäure und Katalysatoren aufgeschlossen werden.
d) Bestimmung der Halogene. Durch oxidativen oder reduktiven Aufschluß wird zunächst die Bindung des Halogens mit dem organischen Molekül gelöst. Als oxidativer Aufschluß kommen die Verbrennung im Sauerstoffstrom mit Platinkatalysator, das Verbrennen in der Knallgasflamme, der Aufschluß mit Natriumperoxid, das Verbrennen im sauerstoffgefüllten Kolben oder der naßchem. Aufschluß mit Salpetersäure (Carius-Methode) oder Chromschwefelsäure in Frage. Reduktive Aufschlußverfahren sind z. B. Verbrennen im Wasserstoffstrom am Katalysator oder Aufschluß mit Natrium, Kalium oder Magnesium. Sowohl oxidativ als auch reduktiv wird beim Bombenaufschluß (Aufschluß) verfahren. Für die Endbestimmung der Halogenide steht eine ganze Reihe von Methoden zur Verfügung: gravimetrische, acidimetrische, argentometrische, iodometrische, merkurimetrische, potentiometrische oder amperometrische Verfahren.
e) Bestimmung des Schwefels. Die Aufschlußmethoden entsprechen denen der Halogenbestimmung. Schwefel liegt nach dem Aufschluß als Sulfat vor. Anderenfalls wird er in dieses übergeführt. Die Endbestimmung erfolgt meist gravimetrisch (Fällung als Bariumsulfat) oder maßanalytisch. In neuerer Zeit werden zunehmend kommerzielle Multielementanalysatoren eingesetzt, die bei entsprechendem Ausrüstungsgrad vollautomatischen Betrieb von der Probeninjektion bis zur Erstellung des Analysenprotokolls gestatten. Durch fortwährende elektronische Überwachung und Regelung aller Analysenparameter wird eine hohe Konstanz der Arbeitsbedingungen und damit eine hohe Reproduzierbarkeit erreicht. Subjektive Fehlereinflüsse werden weitgehend ausgeschaltet, und der Zeitaufwand sinkt erheblich. Die Mineralisierung der organischen Probe erfolgt durch trockene Pyrolyse, die Verbrennungsprodukte werden chromatographisch oder durch selektive Absorption getrennt. Für die Endbestimmung in Analyzern für Kohlenstoff, Wasserstoff, Stickstoff u. a. wird meist die Wärmeleitfähigkeit (statisch oder dynamisch) eingesetzt.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.