Lexikon der Chemie: Halogenalkane
Halogenalkane, Alkylhalogenide, gesättigte aliphatische Halogenkohlenwasserstoffe. In Abhängigkeit von der Anzahl der Halogenatome im Molekül unterscheidet man Mono-, Di-, Tri-, Tetrahalogenalkane usw. Die Bezeichnung der H. erfolgt 1) nach der systematischen Nomenklatur aus dem Namen des entsprechenden Halogenatoms und dem Begriff für das Alkan, z. B. Chlormethan CH3-Cl, 2-Brompropan CH3-CHBr-CH3, 1-Brom-2-chlorethan Br-CH2-CH2-Cl; 2) nach der radikofunktionellen Nomenklatur als alkylsubstituierte Halogenide, z. B. Methylchlorid CH3-Cl, Isopropylchlorid (CH3)2CH-Cl, Methylenbromid CH2Br2. Bei Anwesenheit unterschiedlicher Halogenatome im Molekül kann letztere Nomenklatur nicht angewendet werden. Zahlreiche H. sind farblose Flüssigkeiten mit charakteristisch süßlichem Geruch. Einige Halogenmethan- und -ethanderivate sind gasförmige, höhermolekulare Abkömmlinge feste Verbindungen. Bei Abwesenheit hydrophiler Gruppen sind sie in Wasser unlöslich, in den meisten organischen Lösungsmitteln löslich. Die Halogenatome in H. können normalerweise relativ leicht durch andere nucleophile Reagenzien ausgetauscht werden, dadurch können leicht andere funktionelle Alkanderivate, z. B. Amine, Thiole, Alkohole, Thiocyanate, gebildet werden. Austauschreaktionen eines Halogenatoms durch ein anderes sind unter den Bedingungen der Finkelstein-Reaktion ebenfalls möglich. Durch Dehydrohalogenierung können aus geeigneten H. Alkene und Alkine synthetisiert werden:
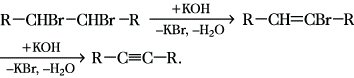
Bei der Einwirkung von Reduktionsmitteln, durch die Wurtz-Reaktion sowie über Grignard-Reaktionen können H. in Alkane umgewandelt werden.
Für die Herstellung von H. sind technisch wichtige Verfahren die Halogenierung von Alkanen und die Veresterung von Alkoholen mit Halogenwasserstoffen: R-OH + HX → R-X + H2O. Außerdem können H. durch Addition von Halogenwasserstoffen an Alkene und Alkine, durch Umsetzung von Alkoholen mit Phosphorhalogeniden oder Thionylchlorid sowie mittels der Hunsdiecker-Reaktion gewonnen werden. Man verwendet H. als Lösungsmittel, Feuerlöschmittel, Kühlmittel, Treibgase für Aerosole, Narkotika sowie für organische Synthesen als Alkylierungsmittel, zur Herstellung von Alkenen u. a.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.