Lexikon der Chemie: Insulin
Insulin, ein in den B-Zellen der Langerhansschen Inseln des Pankreas gebildetes Polypeptidhormon mit blutzuckersenkender Wirkung. I. besteht aus zwei Peptidketten, der A-Kette mit 21 Aminosäureresten und einer intrachenaren Disulfidbrücke und der B-Kette mit 30 Aminosäurebausteinen, wobei beide Ketten durch zwei interchenare Disulfidbrücken zu einem bicyclischen System verknüpft sind. Trotz unterschiedlicher Aminosäuresequenz zeigen die I. verschiedener Spezies in den üblichen biologischen Testsystemen, wie Krampftest an der Maus, Glucoseoxidation im epidermalen Fettgewebe bzw. in isolierten Fettzellen, etwa die gleiche biologische Wirksamkeit. Das monomere I. (Mr ~ 6000) aggregiert abhängig von den Bedingungen zu Dimeren sowie Hexameren. Eine hexamere Anordnung findet man im Insulinkristall mit zwei koordinativ gebundenen Zinkatomen. Von Interesse ist der therapeutisch genutzte Komplex aus I., Zink und Protamin.
I. wurde früher industriell vorrangig aus Pankreata von Schwein und Rind durch Extraktion mit salzsaurem 70%igem Ethanol (pH 1-2) gewonnen. Nach entsprechenden Reinigungsoperationen erhält man Kristallinsulin, das jedoch für anspruchsvolle Zwecke einer Feinreinigung unterworfen werden muß. Aus Rinderpankreas erhält man je kg Drüsen 2000 IE Insulin (27 IE = 1 mg).
Biosynthetisch wird I. über die Vorstufe Prä-Proinsulin gebildet. Die N-terminale Signalsequenz wird noch während der Biosynthese abgespalten, während das Proinsulin durch die Membran in das Innere der Kanälchen des endoplasmatischen Reticulums geschleust wird und schließlich zum Golgi-Apparat gelangt, wo es in I. und C-Peptid gespalten und in Gegenwart von Zink in den Vesikeln gespeichert wird. Durch den entsprechenden physiologischen Reiz (erhöhter Blutglucosespiegel) wird der Vesikelinhalt an das Blut abgegeben.
Die erste erfolgreiche Totalsynthese des I. wurde 1963 von Zahn und wenig später von einer chinesischen und amerikanischen Gruppe beschrieben.
Praktische Bedeutung für die Humaninsulinbereitstellung besitzen die semisynthetische Umwandlung von Schweineinsulin (Abb.) in Humaninsulin (beide unterscheiden sich nur in der C-terminalen Aminosäure der B-Kette), am einfachsten durch trypsinkatalysierte Transpeptidierung in Gegenwart eines geeigneten Threoninderivates, sowie in neuerer Zeit hauptsächlich die gentechnologische Darstellung.
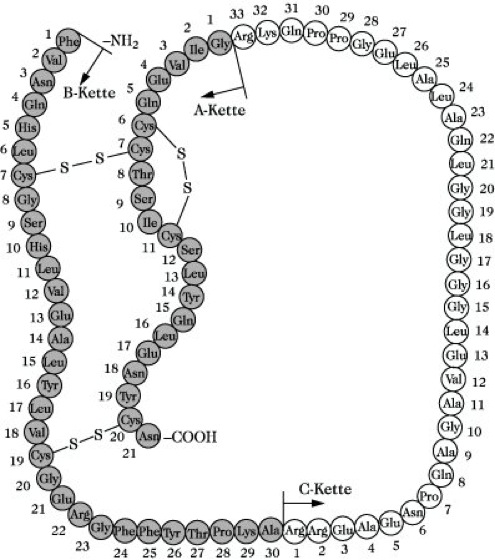
Insulin. Abb.: Primärstruktur des Proinsulins (Schwein).
I. wirkt über den Insulinrezeptor als einziges Hormon gezielt blutzuckersenkend. Es erhöht die Zellpermeabilität für Glucose, aber auch für Aminosäuren, Lipide und K+-Ionen. I. stimuliert die Glycogen- und Proteinsynthese. Neben der Hemmung der Lipolyse inhibiert I. auch die Bildung bestimmter Enzyme der Gluconeogenese. Die typischen Insulinmangelsymptome ergeben das Krankheitsbild des Diabetes mellitus, wobei man die Ursachen der Zuckerkrankheit in ihrer Komplexität noch nicht kennt.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.