Lexikon der Chemie: Konduktometrie
Konduktometrie, Leitfähigkeitsmessung, die Messung der elektrischen Leitfähigkeit von Elektrolytlösungen und deren analytische Anwendung. Die Messung der elektrischen Leitfähigkeit von Elektrolytlösungen ist eine Widerstandsmessung. Sie erfolgt in der Regel zwischen zwei Elektroden, die in eine Elektrolytlösung eintauchen. Die mit einer solchen Anordnung gemessenen Leitfähigkeitswerte werden nicht nur vom Widerstand der Elektrolytlösung bestimmt, sondern auch von einem an der Phasengrenze Elektronenleiter/Ionenleiter auftretenden spannungs- bzw. stromabhängigen Widerstand (Polarisationswiderstand). Bei Messungen mit Gleichstrom kann der Polarisationswiderstand besonders hohe Werte annehmen. Verwendet man dagegen Wechselstrom höherer Frequenzen (bis 50 kHz) und Elektroden hoher Doppelschichtkapazität, z. B. platiniertes Platin, so kann der Polarisationswiderstand gegenüber dem Elektrolytwiderstand vemachlässigt werden. Deshalb werden in der Praxis Messungen der elektrolytischen Leitfähigkeit generell mit Wechselstrom durchgeführt. Man bedient sich dabei der in der Physik für Widerstandsmessungen üblichen Brückenschaltungen.
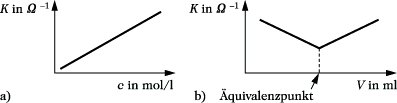
Konduktometrie. Abb.: Signalkurven (a) der Konduktometrie; (b) der konduktometrischen Titration. K spezifische Leitfähigkeit, c Konzentration, V Volumen.
Für die chem. Analytik lassen sich Leitfähigkeitsmessungen in zweierlei Hinsicht anwenden: a) Für wäßrige Lösungen eines Elektrolyten besteht ein charakteristischer Zusammenhang zwischen spezifischer Leitfähigkeit und Konzentration. Somit sind Konzentrationsbestimmungen direkt über die Messung der elektrolytischen Leitfähigkeit möglich. Diese Art der Messung wird vor allem zur Betriebsüberwachung chem. Anlagen und für Reinheitsuntersuchungen (z. B. für destilliertes Wasser oder Kesselspeisewasser) angewandt. b) Der Endpunkt einer Titration kann in geeigneten Fällen mit Hilfe von Leitfähigkeitsmessungen erkannt werden. Diese konduktometrische Titration (Leitfähigkeitstitration) wird vor allem bei Säure-Base- und bei Fällungstitrationen angewandt. So ändert sich z. B. die Leitfähigkeit bei der Titration einer Salzsäure mit Natronlauge wie folgt: In der ersten Phase der Titration treten Hydronium-Ionen der Säure mit Hydroxid-Ionen der Lauge zu undissoziiertem Wasser zusammen, d. h., es werden die Hydronium-Ionen gegen Natrium-Ionen ausgetauscht. Wegen der geringeren Ionengrenzleitfähigkeit der Natrium-Ionen im Vergleich zu den Hydronium-Ionen (Extraleitfähigkeit) sinkt die Leitfähigkeit der Elektrolytlösung ab und erreicht am Äquivalenzpunkt ihren minimalen Wert. In der Phase nach dem Äquivalenzpunkt steigt die Leitfähigkeit durch Zugabe weiterer Natronlaugen an, da nunmehr die Anzahl der im Elektrolyten gelösten Ionen zunimmt.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.