Lexikon der Chemie: Ozon
Ozon, Trisauerstoff, energiereichc Form elementaren Sauerstoffs, D. des flüssigen O. bei -183 °C 1,571 g cm-3, F. -192,7 °C, Kp. -111,9 °C, krit. Temp. -5,16 °C, krit. Druck 6,7 MPa, krit. D. 0,54 g cm-3, Standardelektrodenpotential 2,07 V (O3 + 2 H+ + 2e ![]()
O2 + H2O).
Eigenschaften. O. ist ein blaues, giftiges Gas von charakteristischem Geruch, das bei Abkühlung zu einer tiefdunkelblauen Flüssigkeit kondensiert und schließlich zu blauschwarzen Kristallen erstarrt. Das Ozonmolekül ist gewinkelt (Bindungswinkel 116,5°) und wird durch folgende Resonanzstrukturen beschrieben:
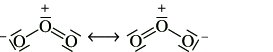
Die Löslichkeit in Wasser ist gering (100 ml Wasser lösen bei 0 °C 49,4 ml O.). Besser löst sich O. in Halogenkohlenwasserstoffen. Als endotherme Verbindung zerfällt O. langsam in Disauerstoff: O3 → 3/2 O2, ΔH = -145 kJ/mol. Reines O., aber auch dessen konz. Lösungen können sich auch bei tiefer Temperatur explosionsartig zersetzen. O. gehört zu den stärksten bekannten Oxidationsmitteln. Beispielsweise werden durch Einwirkung von O. Sulfide zu Sulfaten, Ammoniak zu Salpetersäure und Kohlenstoff zu Kohlendioxid oxidiert. Metalle werden – mit Ausnahme des Goldes, Platins und Iridiums – in die höchsten Oxide überführt. Die vorsichtige Einwirkung von O. auf ungesättigte organische Verbindungen wird zur Ozonisierung Harries-Reaktion) genutzt.
|
Analytisches. Das einfachste Verfahren zur qualitativen und quantitativen Analyse des O. bedient sich der Einwirkung des Gases auf Kaliumiodidlösung gemäß O3 + 2 KI + H2O → I2 + 2 KOH + O2, wobei das Iod volumetrisch oder auch kalorimetrisch bestimmt werden kann.
Vorkommen.O. bildet sich überall dort, wo atomarer Sauerstoff entsteht, der auf molekularen einwirken kann: O + O2 → O3. Als Folge der durch die UV-Strahlung der Sonne bewirkten Homolyse des O2 zu atomarem Sauerstoff und dessen Vereinigung mit O2 zu O3 ist O. ständiger Bestandteil der Erdatmosphäre. Die Konzentration an der Erdoberfläche liegt bei 3·10-15 und hat in 20 bis 25 km Höhe ein Maximum von etwa 2·10-5 Vol.-% (Ozon-Loch). Gleichermaßen entsteht O. in der Nähe von Quarzlampen oder radioaktiven Präparaten und bei elektrischen Entladungen, z. B. bei Gewittern. Auch bei der Zersetzung von Peroxiden oder der Elektrolyse von Schwefelsäure oder Perchlorsäure tritt O. auf.
Zur Gewinnung des O. bedient man sich der Einwirkung stiller elektrischer Entladungen auf einen Sauerstoffstrom entsprechend dem Prinzip des Siemensschen Ozonisators. Dieser besteht im wesentlichen aus zwei konzentrisch angeordneten, mit elektrisch leitenden Belägen versehenen Röhren. (Abb.) Mit Hilfe eines hochgespannten Wechselstroms werden in dem von Sauerstoff durchströmten Zwischenraum stille elektrische Entladungen erzeugt, wodurch ein Teil des O2 in O. umgewandelt wird. Bei guter Kühlung (um unerwünschte Zersetzung zu vermeiden) erhält man Sauerstoffgemische mit einem Ozonanteil von bis zu 15 %.
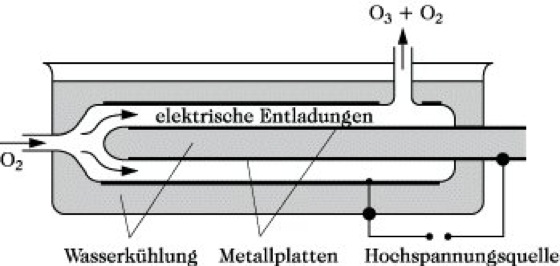
Ozon. Abb.: Prinzip des Siemensschen Ozonisators.
Verwendung. Das wichtigste Einsatzgebiet für O. ist die Trink- und Abwasserbehandlung.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.