Lexikon der Chemie: Peptidbindung
Peptidbindung, der wichtigste kovalente Bindungstyp zwischen den Aminosäurebausteinen in Peptiden und Proteinen. Formal handelt es sich um eine N-substituierte Carbonsäureamidgruppierung, die durch Reaktion der aktivierten Carboxygruppe einer Aminosäure mit der nucleophilen Aminogruppe einer zweiten Aminosäure gebildet wird. Da das Elektronenpaar am N-Atom in Konjugation zur Carbonylgruppe steht, resultiert ein mesomeriebedingter partieller Doppelbindungscharakter der P. (I). Die Einschränkung der freien Drehbarkeit um die C-N-Achse ergibt mit der trans-P. (ω = 180°) und der cis-P. (ω = 0°) zwei verschiedene planare Anordnungen (II).
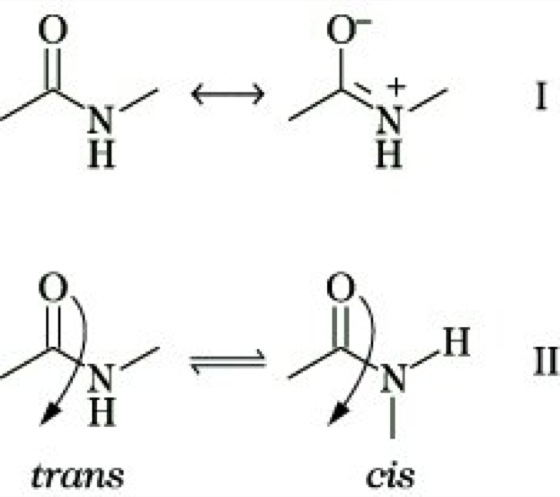
Die energetisch geringere trans-P. findet man in allen Peptiden, in denen kein Prolin vorkommt. Bei Xaa-Pro-P. ist mit 6,5 % cis-Anordnung dieser Anteil im Vergleich zu nur etwa 0,05 % cis-Orientierung aller bekannten Peptidbindungen deutlich höher. Die cis/trans-Isomerisierung von Peptidbindungen N-terminal zu einem Prolinbaustein wird nach Untersuchungen von G. Fischer durch Peptidyl-Prolyl-cis/trans-Isomerasen (Abk. PPIasen) katalysiert und hat große Bedeutung für das zelluläre Geschehen.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.