Lexikon der Chemie: Photoelektronenspektroskopie
Photoelektronenspektroskopie, PES, spektroskopische Methode, mit der die Energieverteilung von Elektronen gemessen wird, die durch Lichtquanten aus Atomen, Molekülen oder einem Festkörperverband herausgeschlagen werden. Entsprechend der Gleichung M+ h·ν = M+ + e- wird eine Probe mit Röntgen- oder UV-Strahlung bekannter Energie h·ν angeregt. Durch Absorption dieser Strahlung kommt es zur Emission von Elektronen, deren kinetische Energie Ekin analysiert wird. Aus Ekin ergibt sich die Bindungsenergie EBder Elektronen zu EB = hv – Ekin- φ, wobei φ die Austrittsarbeit darstellt. Bei der Untersuchung von gasförmigen Stoffen entfällt φ, und die ermittelten Bindungsenergien können den Ionisationsenergien bzw. den Energieniveaus der verschiedenen Elektronenzustände gleichgesetzt werden. Man kann das Photoelektronenspektrum als ein um 90° gedrehtes Energiediagramm der Atome oder Moleküle betrachten. Die P. ist deshalb eine der wichtigsten Methoden, die experimentelle Angaben liefert, die mit quantenchem. Rechnungen verglichen werden können.
Je nach der zur Anregung verwendeten Strahlung unterscheidet man zwischen Röntgen-PES (X-PES oderXPS), bei der innere Elektronen angeregt werden, und UV-PES oder UPS, die zur Spektroskopie der Valenzelektronen dient. XPS wird auch als Elektronenspektroskopie für chem. Analyse (ESCA) oder induzierteElektronenemission (IEE) bezeichnet, während man unter PES im engeren Sinne häufig die UPS versteht. In einem Photoelektronenspektrometer werden in der XPS als Strahlungsquelle Röntgenröhren benutzt. Häufig wird die Kα-Strahlung von Aluminium (1487 eV) oder Magnesium (1253 eV) verwendet. In der UPS dienen die Resonanzlinien von Helium (21,21 eV) und He+ (40,82 eV) als Strahlungsquelle. Die Proben werden hauptsächlich im gasförmigen oder festen Zustand untersucht. Die Analyse der kinetischen Energie geschieht im Analysator durch das Anlegen elektrostatischer oder magnetischer Felder. Je nach der Größe ihrer kinetischen Energie werden die Elektronen darin verschieden abgelenkt. Durch Variation der Feldstärke kann man erreichen, daß nacheinander die Elektronen unterschiedlicher kinetischer Energie auf den Detektor gelenkt und registriert werden. Als Detektor kommt in vielen Fällen ein Sekundärelektronenvervielfacher zur Anwendung. Die Messungen erfolgen im Hochvakuum (bis zu 10-8 Pa) und bei Temperaturen von -190 bis +1800 °C. Im Photoelektronenspektrum wird die Anzahl der Elektronen, die den Detektor erreicht, als Funktion ihrer Energie aufgezeichnet (Abb.).
Grundlagen für die Anwendung der P. in der Chemie sind folgende 3 Punkte. 1) Verschiedene Elemente haben für die gleichen Niveaus unterschiedliche Bindungsenergien, so daß man für jedes Element charakteristische Signale findet, die zu seinem Nachweis dienen können. Dies zeigt die Abb., wo das Photoelektronenspektrum von KNO3, angeregt mit Mg-Kα-Strahlung, aufgezeichnet ist. Die unterschiedlichen Signale für O 1s, N 1s, K 2s, K 2p Anregungen sind deutlich erkennbar. Der erkennbare Kohlenstoff stellt eine Verunreinigung dar. 2) Atome des gleichen Elements haben in Abhängigkeit von ihren Bindungsverhältnissen geringfügig unterschiedliche Bindungsenergien, die die Ursache für das Auftreten chemischerVerschiebungen sind. So findet man beispielsweise im Ethanal CH3-CHO für die 1 s Elektronen der beiden C-Atome unterschiedliche Signale. In vielen Fällen tritt auch eine deutliche Abhängigkeit der chem. Verschiebung von der Oxidationsstufe des betreffenden Elements auf (Tab.). Man bevorzugt die Messung der chem. Verschiebung an inneren Schalen, da hier die Interpretation einfacher ist. 3) Bei Festkörperuntersuchungen stammen die erhaltenen Informationen aus oberflächennahen Bereichen, da die Austrittstiefe der Photoelektronen begrenzt ist und bei Röntgenanregung bis zu etwa 5 nm, bei UV-Anregung bis zu 1 nm beträgt. Elektronen aus größerer Tiefe verlieren durch unelastische Streuprozesse ihre kinetische Energie und gelangen so entweder nicht oder mit verminderter Energie und damit als Streuuntergrund in den Analysator.
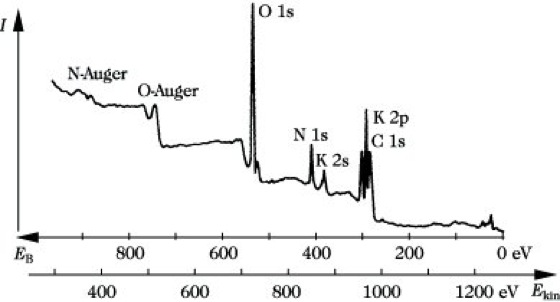
Photoelektronenspektroskopie. Abb.: Übersichtsspektrum von Kaliumnitrat KNO3 (Anregung mit Mg-Kα-Strahlung).
Die P. zeichnet sich deshalb durch eine extreme Oberflächenempfindlichkeit aus. Es können damit solche Probleme wie Adsorptions- oder Korrosionserscheinungen an Oberflächen, Veränderungen von Katalysatoroberflächen oder von polymeren Fasern bei einer chem. Behandlung sowie viele analoge Probleme untersucht werden. Schrittweises Abtragen der Probenoberfläche durch Beschuß mit Argonionen (Sputtern) eröffnet Möglichkeiten für Tiefenprofilanalysen.
Zusätzliche Signale (Abb.) in der XPS kommen dadurch zustande, daß die bei der Photoionisation erzeugte Leerstelle durch einen strahlungslosen Übergang unter Abgabe eines Elektrons (Auger-Elektron) aufgefüllt wird (Auger-Elektronenspektroskopie).
Photoelektronenspektroskopie. Tab.: Abhängigkeit der chem. Verschiebung von der Oxidationsstufe in eV.
| |||||||||
| Ele- ment | -2 | -1 | 0 | +1 | +3 | +4 | +5 | +6 | +7 |
| N(1s) | – | 0 | – | +4,5 | +5,1 | – | +8,0 | – | – |
| S(1s) | -2,0 | – | 0 | – | – | +4,5 | – | +5,8 | – |
| Cl(2p) | – | 0 | – | – | +3,8 | – | +7,1 | – | +9,5 |
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.