Lexikon der Chemie: Säure-Base-Konzepte
Säure-Base-Konzepte, Klassifikations- und Begriffssysteme, welche gestatten, Säure-Base-Reaktionen unter einheitlichen Gesichtspunkten zu betrachten.
Arrheniussche Säure-Base-Definition. Arrhenius (1887) definiert Säuren als Stoffe, die in wäßriger Lösung unter Bildung von H+-Ionen, Basen als Stoffe, die in Wasser unter Bildung von OH--Ionen dissoziieren. Die Reaktion einer Säure mit einer Base wird als Neutralisation bezeichnet, deren wesentlicher Vorgang die Vereinigung von H+- und OH--Ionen zu Wasser ist. Nachteil: Verbindungen, wie Ammoniak, Elementorganyle u. a., welche H+-Ionen neutralisieren können, werden von der Basedefinition nicht erfaßt. Das Konzept ist heute weitgehend durch das Brönstedsche System abgelöst worden.
Brönstedsche Säure-Base-Definition. Brönsted und Lowry definierten gleichzeitig (1923) und unabhängig voneinander Säuren als Systeme, die Protonen abgeben, d. h. als Protonendonatoren fungieren können, Basen als Systeme, die Protonen aufnehmen, d. h. als Protonenakzeptoren fungieren können. Diese im wesentlichen funktionelle Definition schließt geladene Teilchen ein, und man unterscheidet deshalb Neutralsäuren(z. B. H2SO4, HNO3), Neutralbasen (z. B. NH3, H2O), Anionsäuren (z. B. HCO-3, H2PO4-) und Anionbasen (z. B. HCO3-, OH-) sowie Kationsäuren (z. B. NH4+, H3O+) und Kationbasen (z. B. [Al(OH)(H2O)5]2+). Säuren, die ein Proton abgeben können, werden als einbasig (oder einwertig) bezeichnet (z. B. HNO3, HCl, HClO4). Entsprechend können zweibasige Säuren (z. B. H2SO4, H2CO3, H2PO4-) zwei, dreibasige Säuren (z. B. H3PO4, H3AsO4) drei Protonen zur Verfügung stellen und nach partieller Dissoziation saure Salze bilden. Analog vermögen einsäurige Basen (z. B. OH-, NH3) ein Proton, zweisäurige Basen (z. B. O2-, SO42-, HPO42-) zwei Protonen aufzunehmen.
Das S. ist nicht auf wäßrige Systeme beschränkt, sondern kann zur Beschreibung von Reaktionen auch in nichtwäßrigen Lösungsmitteln und in der Gasphase dienen.
Da Protonen nicht in freiem Zustand existieren können, benötigt die Dissoziation einer Säure (Protonendonator) immer die Gegenwart einer Base, welche die freien Protonen aufnimmt (Protonenakzeptor). Man nennt diesen Vorgang Protolyse. Dissoziiert eine Säure, so entsteht neben dem Proton ein Rest, der seinerseits in der Lage ist, ein Proton aufzunehmen, also eine Base darstellt. Man bezeichnet diesen Rest als korrespondierende Base. Unterscheiden sich eine Säure und eine Base also nur durch ein Proton, nennt man sie korrespondierendes Säure-Base-Paar. So ist z. B. das Chlorid die korrespondierende Base der Säure HCl und das Ammonium die korrespondierende Säure der Base Ammoniak NH3.
Säure-Base-Konzepte. Tab. 1: Wichtige korrespondierende Säure-Base-Paare und deren pKS- und pKB-Werte.
| |||||||
| sehr stark | -10 -10 -9 -6 -2 -1 | ,74 | HClO4 HI HBr HCl H2SO4 H3O+ | + H2O H3O+ + ClO-4 + H2O H3O+ + I- + H2O H3O+ + Br- + H2O H3O+ + Cl- + H2O H3O+ + HSO4- + H2O H3O+ + H2O | 24 24 23 20 17 15 | ,74 | sehr schwach |
| stark | -1 1 1 3 | ,32 ,92 ,96 ,14 | HNO3 HSO4- H3PO4 HF | + H2O H3O+ + NO3- + H2O H3O+ + SO42- + H2O H3O+ + H2PO4- + H2O H3O+ + F- | 15 12 12 10 | ,32 ,08 ,04 ,86 | schwach |
| mittelstark | 4 6 6 | ,76 ,52 ,92 | CH3COOH H2CO3 H2S | + H2O H3O+ + CH3COO- + H2O H3O+ + HCO3- + H2O H3O+ + HS- | 9 7 7 | ,24 ,48 ,08 | mittelstark |
| schwach | 9 9 12 | ,21 ,40 ,90 | NH4+ HCN HS- | + H2O H3O+ + NH3 + H2O H3O+ + CN- + H2O H3O+ + S2- | 4 4 1 | ,79 ,60 ,10 | stark |
| sehr schwach | 15 23 34 | ,74 | H2O NH3 CH4 | + H2O H3O+ + OH- + H2O H3O+ + NH2- + H2O H3O+ + CH3- | -1 -9 -20 | ,74 | sehr stark |
Verbindungen, die sowohl als Säure als auch als Base fungieren können, werden als Ampholytebezeichnet (z. B. HCO3-, HPO24-, H2O, NH3). Amphoteres Verhalten ist die Voraussetzung zur Autoprotolyse (Säure-Base-Disproportionierung), d. i. die Fähigkeit eines Systems, sich selbst zu protonieren, z. B. HPO24-+ HPO24-![]()
H2PO4- + PO34-. Das Autoprotolysegleichgewicht des Wassers gemäß H2O + H2O ![]()
H3O++ OH- ist für das Verständnis zahlreicher in Wasser ablaufender Prozesse von fundamentaler Bedeutung (pH-Wert, Ionenprodukt).
Will man die Stärke einer Säure oder Base als das Ausmaß ihrer Dissoziation beschreiben, ist es erforderlich, diese auf die Wechselwirkung mit einer Standardbase bzw. -säure zu beziehen. Als solche eignet sich das amphotere Wasser, und man gibt als Maßzahl für die Säurestärke (Acidität) die Gleichgewichtskonstante der Reaktion der Säure (HA) mit Wasser, die Säurekonstante KS bzw. deren negativen dekadischen Logarithmus, den Säureexponenten pKS an:
HA + H2O ![]()
A- + H3O+,
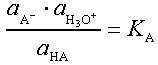
pKS = -lg KS
Analog gilt als Maßzahl für die Basestärke (Basizität) die Gleichgewichtskonstante der Reaktion dieser Base (B) mit Wasser, die Basekonstante KB bzw. ihr negativer dekadischer Logarithmus, der Baseexponent pKB:
B + H2O ![]()
A- + H3O+
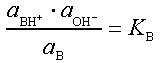
pKB = -lg KB.
Große Säurekonstanten (kleine pKS-Werte) entsprechen starken, kleine Säurekonstanten (große pKS-Werte) schwachen Säuren; analog gilt dies für Basen. Säure- und Basekonstanten korrespondierender Säure-Base-Paare weisen immer ein konstantes Produkt auf, welches dem Ionenprodukt des Wassers entspricht: KS·KB = KW (KW = 10-14) bzw. pKS+ pKB = pKW + pKW = 14, Ionenprodukt des Wassers, d. h. zu einer starken Säure gehört immer eine schwache korrespondierende Base und umgekehrt (s. Tab. 1). Dies macht klar, weshalb es beim Auflösen von Salzen in Wasser oftmals zu erheblichen pH-Wertverschiebungen kommt.
Aufgrund der Basenwirkung des Wassers liegen starke Säuren in Wasser vollständig dissoziiert vor, d. h. sie liegen stets in der Form H3O+ und ihrer korrespondierenden Basen vor. Somit zeigen wäßrige Lösungen aller sehr starken Säuren das gleiche Verhalten, das auf die H3O+-Ionen zurückgeht. Das H3O+-Ion ist also die stärkste existierende Säure in Wasser. Man bezeichnet diese Erscheinung als den nivellierenden Effekt (levelling effect) des Wassers. Ebenso sind stärkere Basen als das Hydroxid-Ion OH- in Wasser nicht existent. Die außerordentliche Protonierungsaktivität extrem starker Säure gegenüber sehr schwachen Basen kann deshalb nur in nichtwäßrigen Medien zur Wirkung kommen (Supersäuren). Die Brönstedsche Säure-Base-Definition hat sich vor allem in der Behandlung von Protonenübertragungsreaktionen in Wasser wie auch in nichtwäßrigen Lösungsmitteln außerordentlich bewährt und weitgehend durchgesetzt.
Lewissche Säure-Base-Definition. Nach Lewis (1923) sind Basen Moleküle oder Ionen, die einem Reaktionspartner ein Elektronenpaar zur Ausbildung einer kovalenten Bindung zur Verfügung stellen, d. h. Elektronenpaardonatoren, unter Berücksichtigung kinetischer Aspekte auch nucleophile Reagenzien (Nucleophile); Säuren sind Moleküle oder Ionen, die über eine Elektronenlücke verfügen, d. h. Elektronenpaarakzeptoren, kinetisch gesehen auch elektrophile Reagenzien (Elektrophile), die mit Basen unter Knüpfung einer Kovalenz reagieren können. Damit sind all jene Teilchen als Lewis-Säuren zu charakterisieren, die über unbesetzte, energetisch niedrig liegende Atom- bzw. Molekülorbitale verfügen. Dazu zählen generell Kationen (z. B. Ag+, Cu2+ Br+, R3C+), Moleküle mit einem unvollständigen Elektronenoktett (z. B. BF3, AlCl3, SO3, BeCl2), koordinativ ungesättigte Verbindungen, deren Zentralatome eine Oktetterweiterung erlauben (z. B. SiF4, SnCl4, PCl3, SbF5), und Moleküle mit polaren Mehrfachbindungen, in denen das positivierte Atom Träger der sauren Eigenschaften ist (z. B. CO2, Carbonylverbindungen). Entsprechend sind Lewis-Basen solche Teile, die über besetzte, energetisch relativ hoch liegende Atom- bzw. Molekülorbitale verfügen. Dies sind Moleküle mit freien, zur Bindungsbildung nicht benutzten Elektronenpaaren, Anionen, die z. B. gegenüber Metallkationen bei der Komplexbildung als Basen auftreten, oder Moleküle mit polaren Mehrfachbindungen, in denen das negativierte Atom als Basezentrum fungiert. Als Ergebnis der Wechselwirkung von Lewis-Säuren mit Lewis-Basen resultieren Neutralisationsprodukte, in denen die Komponenten durch Kovalenzen verknüpft sind.
Säure-Base-Konzepte. Tab. 2: Reaktionen von Lewis-Säuren und Lewis-Basen.
| |||
| BF3 | + NH3 | F3B--+NH3 | |
| AlCl3 | + Cl- | [AlCl4]- | |
| Ag+ | + 2 NH3 | [Ag(NH3)2]+ | |
| CO2 | + OH- | HCO3- | |
| H+ | + OH- | H2O |
Die Lewissche Säure-Base-Definition hat breiteste Anwendung vor allem in der Diskussion von Reaktionsabläufen in der organischen Chemie und Koordinationschemie, gefunden (HSAB-Konzept, s. u.).
HSAB-Konzept. Im HSAB-Konzept(von engl. hard and soft acids and bases), Prinzip der harten und weichen Säuren undBasen, 1963 von Pearson veröffentlicht, wird versucht, auf der Grundlage der Lewisschen Definition Kriterien anzugeben, die die Stabilität des aus der Wechselwirkung von Säure und Base resultierenden Produktes zu bestimmen gestatten. Es zeigt sich, daß die Gleichgewichtslage Lewis-Säure + Lewis-Base ![]()
Säure-Base-Komplex vorrangig von der Elektronegativität und der Polarisierbarkeit, d. h. der Deformierbarkeit der Elektronenhüllen, der an der Reaktion beteiligten Spezies beeinflußt wird. Unter diesem Aspekt lassen sich Lewis-Säuren und -Basen klassifizieren, indem man wie folgt definiert. Harte Säuren: Lewis-Säuren geringer Polarisierbarkeit, d. s. kleine, hoch geladene Kationen sowie Moleküle, in denen durch die Bindungspartner eine hohe positive Ladung am Zentralatom induziert wird (z. B. H+, Li+, Mg2+ Al3+, Ti4+, Fe3+, CO2, SO3). Weiche Säuren: Lewis-Säuren hoher Polarisierbarkeit, z. B. Kationen mit großem Radius und niedriger Ladung sowie Moleküle mit relativ hoch liegenden besetzten Molekülorbitalen (z. B. Ag+, Cu2+, Pd2+, Pt2+, Carbene, Br2, I2). Harte Basen: Lewis-Basen hoher Elektronegativität und somit geringer Polarisierbarkeit (z. B. NH3, H2O, OH-, OR-, F-). WeicheBasen: Lewis-Basen geringer Elektronegativität und somit großer Polarisierbarkeit (z. B. H-, CN-, R3P, RSH, I-). Die Begriffe hart und weich sind relativ zu verstehen, stufenlose Übergänge sind möglich. Pearson stellte fest, daß sich harte Säuren bevorzugt mit harten Basen umsetzen, während weiche Säuren bevorzugt mit weichen Basen reagieren. Dieses Prinzip hat sich bei der Abschätzung von Gleichgewichtslagen und der Stabilität entsprechender Produkte vor allem in der organischen Chemie und der Koordinationschemie außerordentlich bewährt. Als Beispiel sei angeführt, daß als hart oder weich charakterisierte Komplexliganden und Zentralionen bei einer hart-hart- oder weich-weich-Wechselwirkung sehr viel stabilere Komplexe liefern als bei einer weich-hart-Kombination.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.