Lexikon der Ernährung: Biotinenzyme
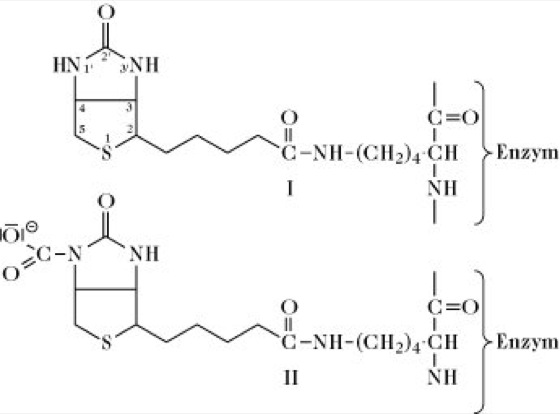
Biotinenzyme, Ebiotin-dependent carboxylases, vier biotinabhängige Enzyme, die Carboxylierungsreaktionen katalysieren. Biotin ist (als prosthetische Gruppe) über eine Amidbindung an die ℇ-Aminogruppe eines spezifischen Lysinrests des Enzymproteins gebunden, d. h. die B. enthalten einen Biotinyllysylrest. Freies (+)-ℇ-N-Biotinyl-L-Lysin wird als Biocytin bezeichnet. Während der Katalyse wird das N-Atom 1’ des Biotinrests in einer ATP-abhängigen Reaktion durch eine Biotin-Carboxylase-Untereinheinheit des Enzyms carboxyliert:
ATP + HCO3– + Biotinyl-Enzym (I) →ADP + Pi + Carboxybiotinyl-Enzym (II).
Die Carboxylgruppe wird dann von Enzym (II) auf das Carboxylasesubstrat übertragen:
(II) + Substrat → (I) + carboxyliertes Substrat (Abb.).
Die B. sind:
1. die Pyruvat-Carboxylase (EC 6.4.1.1). Sie ist Schlüsselenzym der Gluconeogenese und überführt in den Mitochondrien Pyruvat in Oxalacetat. Eine weitere wichtige Funktion erfüllt sie bei der Lipogenese.
2. die Propionyl-CoA-Carboxylase (EC 6.4.1.3), die die Bildung von Methylmalonyl-CoA aus Propionyl-CoA katalysiert, welches durch Oxidation ungeradkettiger Fettsäuren, Abbau von Methionin, Isoleucin und Valin anfällt. Methylmalonyl-CoA wird weiter zu Succinyl-CoA und Oxalacetat abgebaut (Gluconeogenese oder Energieversorgung).
3. die 3-Methylcrotonyl-CoA-Carboxylase (EC 6.4.1.4): Durch dieses Enzym wird 3-Methylcrotonyl-CoA in 3-Methylglutaconyl-CoA überführt, eine Reaktion, die beim Katabolismus von Leucin eine Rolle spielt.
4. die Acetyl-CoA-Carboxylase (EC 6.4.1.2), die die Carboxylierung von Acetyl-CoA unter Bildung von Malonyl-CoA katalysiert (erster Schritt der Fettsäurebiosynthese).
Biotinenzyme: Strukur des Biotinyl-Enzyms (I) und des Carboxybiotinyl-Enzyms (II). Biotinenzyme
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.