Lexikon der Ernährung: Calciferole
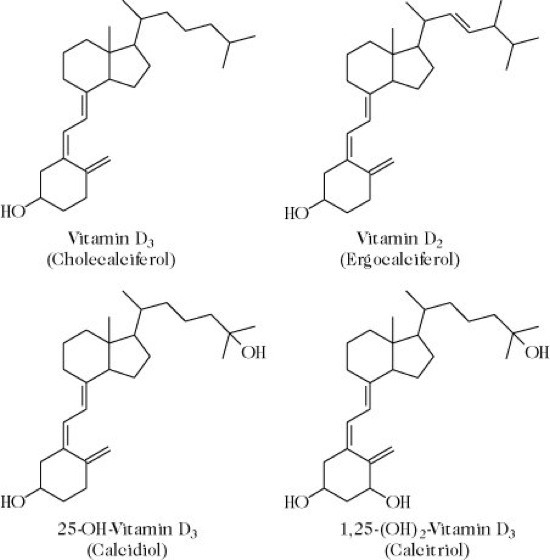
Calciferole, Vitamin D, antirachitisches Vitamin, Evitamin D, calciferol, eine Reihe von Verbindungen, die alle antirachitische Aktivität aufweisen und als Vitamin-D-Familie bezeichnet werden (Abb.). Sie besitzen – wie alle Steroide – das typische Ringsystem von Cholesterin. Vitamin D3 (Cholecalciferol) und Vitamin D2 (Ergocalciferol) sind für den Menschen die beiden wichtigsten. Sie werden unter UV-Einfluss (Photoisomerisierung, Thermoisomerisierung) aus 7-Dehydrocholesterin (= Provitamin D3) bzw. Ergosterin (= Provitamin D2) gebildet. Vitamin D ist als Prohormon einzuordnen und auf Grund der Eigensynthese unter UV-Licht und Wärme nur teilweise essenziell.
Eigenschaften: C. gehören zu den fettlöslichen Vitaminen und sind als gelbliches Puder darstellbar, mit einem UV-Absorptionsmaximum bei 265 nm. Sie sind empfindlich gegenüber Sauerstoff, Licht und alkalischen Bedingungen.
Vorkommen: C. kommen in der Natur nur sehr begrenzt vor. Hohe Gehalte weisen Fisch (bis 26 µg%) und Leber (bis 1,7 µg%) auf, mittlere Gehalte Butter (1,3 µg%), Milch (0,1 µg%) und Emmentaler (1,2 µg%). Die Zubereitungsverluste sind gering, die körpereigenen Reserven reichen für 2–6 Wochen aus.
Bedarf (nach DGE): Generell wird angenommen, dass ein Großteil des Bedarfs durch die Eigensynthese (abhängig von Sonneneinstrahlung, Aufenthaltsdauer im Freien) gedeckt wird. Erwachsene haben einen Bedarf von 5 µg / d (200 IE / d). Dabei ist 1 µg = 40 IE (Internationale Einheiten).
Resorption, Metabolismus: Die Resorption von Vitamin D erfolgt im Dünndarm über passive Diffusion (abhängig von Gallensalzen und Micellenbildung). Es wird zunächst in Chylomikronen eingebaut und im Blut sowohl auf ein Vitamin D-bindendes Protein (DBP = Transcalciferin) übertragen als auch mit Chylomikronen-Resten in die Leber aufgenommen. In der Leber wird C. durch eine mischfunktionelle Monooxygenase in Mitochondrien und Mikrosomen zu 25-OH-Cholecalciferol hydroxyliert. Diese Reaktion unterliegt keiner Regulierung. Wieder an DBP gebunden wird 25-OH-Cholecalciferol zur Niere transportiert, wo in den Mitochondrien des proximalen Tubulus eine weitere Hydroxylierung an der α-Stellung des C1 stattfindet (katalysiert durch 25-OH-Vitamin-D1-Hydroxylase [mischfunktionelle Monooxygenase]). Es entsteht 1,25-(OH)2-Cholecalciferol. Hydroxylierung am C24 durch 25-OH-VitaminD-24-Hydroxylase führt zu 24R,25-(OH)2-Cholecalciferol. Beide Produkte können weiter in 1,24R,25-Trihydroxycholecalciferol (1,24,25-(OH)3-Cholecalciferol) umgewandelt werden. Die Bildung des Steroidhormons 1,25-(OH)2-Cholecalciferol unterliegt einer fein abgestimmten Regulation, die direkt durch Parathyrin (Parathormon) durch Aktivierung der Hydroxylase und 1,25-(OH)2-Cholecalciferol und Phosphat (Hemmung) beeinflusst wird. Indirekt beeinflussen Calcium, Östrogen, Glucocorticoide, Calcitonin, Wachstumshormone und Prolactin die Bildung (meist über das Parathormon). Die Bildung von 24,25-(OH)2-Cholecalciferol wird durch die gleichen Faktoren beeinflusst nur in umgekehrter Richtung, d. h. 1,25-(OH)2-Cholecalciferol und Phosphat stimulieren und das Parathormon hemmt.
Biochemische Funktionen: 1,25-(OH)2-Cholecalciferol wirkt wie ein Steroidhormon und wird am Zielorgan an ein intrazelluläres Rezeptorprotein gebunden und in den Zellkern transportiert. Dort bindet der Vitamin-Rezeptor-Komplex an die DNA und verändert die Transcription, was zu einer veränderten Proteinbiosynthese führt. Die Hauptaufgabe des Vitamin D ist die Regulation des Calcium- und Phosphathaushaltes (mit den vier klassischen Zielorganen Darm, Knochen, Niere und Nebenschilddrüse). An dieser Regulation sind zwei weitere endokrine Systeme beteiligt, das Parathyrin (Nebenschilddrüse) und Calcitonin (Schilddrüse).
– Im Darm steigert 1,25-(OH)2-Cholecalciferol die Synthese eines Calcium-bindenden Proteins (Calbindin D), was zu einer gesteigerten Calciumresorption und Phosphatresorption aus dem Lumen ins Blut führt.
– Im Knochen spielt 1,25-(OH)2-Cholecalciferol sowohl bei der Mineralisierung (Knochenbildung) als auch bei der Mobilisierung von Mineralstoffen eine Rolle. Es ist auch bei der Mineralisierung des Zahnschmelzes von Bedeutung.
– In der Niere hemmt 1,25-(OH)2-Cholecalciferol die Hydroxylierung von 25-OH-Cholecalciferol in der 1α-Position und stimuliert gleichzeitig die Hydroxylierung an C24. Zusätzlich wirkt es auf die renale Rückresorption und Exkretion von Calcium und Phosphor.
– In der Nebenschilddrüse besteht eine wechselseitige Beziehung zwischen Parathormon und 1,25-(OH)2-Cholecalciferol. Parathormon stimuliert die 1,25-(OH)2-Cholecalciferol-Synthese in der Niere, dessen erhöhter Spiegel senkt die Ausschüttung von Parathyrin in der Nebenschilddrüse.
Weitere Zielorgane, in denen 1,25-(OH)2-Cholecalciferol unterschiedliche Funktionen erfüllt, sind Pankreas (Insulinausschüttung), Gehirnabschnitte (Wirkung auf Cholinacetyltransferase), Muskel (Calciumtransport) und Haut (Zellwachstum, Differenzierung).
Mangel: Klinisches Symptom eines Calciferolmangels (Ecalciferol deficiency,vitamin D deficiency) ist die Demineralisierung der Knochen. Das führt bei Kindern zu Rachitis (Dickenzunahme v. a. im Gelenkbereich, Verzögerung des Fontanellenschlusses), bei Erwachsenen zu Osteomalazie (muskuläre Schwäche, Knochenschmerz, Frakturen). Suboptimale Versorgung bewirkt Muskelkrämpfe, eine Deformation der Zahnstellung und erhöhte Knochenbruchgefahr.
Überdosierung: Eine Überdosierung ist nur durch exzessive Einnahme pharmakologischer Dosen (50.000 IE / d = 1,25 mg / d) zu erreichen. Symptome sind Hypercalcämie, Hypercalcurie, Erbrechen, Schwindel, Muskelschwäche, Verkalkungen (Calcinose) v. a. von Haut, Niere, Leber und Blutgefäßen.
Therapie: Hier ist die Gefahr einer Hypervitaminose wegen der schmalen therapeutischen Breite der Dosis-Wirkungsbeziehung sehr groß. Bei Osteomalazie werden 100.000–300.000 IE / d (2,5–7,5 mg / d) eingesetzt, bei Rachitis 10.000–100.000 IE / d (0,25–2,5 mg / d).
Statusbestimmung: 25-OH-Cholecalciferol (Calcidiol) wird im Serum mithilfe eines kompetitiven Proteinbindungsassays (Normalwert: 30 ng / ml), mit Radioimmunassay oder HPLC (UV-Detektion) bestimmt. Störungen der Vitamin D-Metabolisierung bedingen die zusätzliche Bestimmung von 1,25-(OH)2-Cholecalciferol (= Calcitriol, Serum-Normalwert 40 pg / ml) mittels der gleichen Methoden.
Calciferole: Strukturformeln der Calciferole. Calciferole
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.