Lexikon der Ernährung: Purinbiosynthese
Purinbiosynthese, de-novo-Purinsynthese, Epurine biosynthesis, ein allgemeiner Pfad zur Neusynthese des Purinringsystems, der auf allen Stufen der evolutionären Entwicklung vertreten ist. Beim Erwachsenen werden täglich etwa 400–700 mg Purin- und Pyrimidinbasen neu synthetisiert, ein weiterer Anteil wird aus den mit der Nahrung aufgenommenen Nucleobasen wiederverwertet.
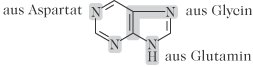
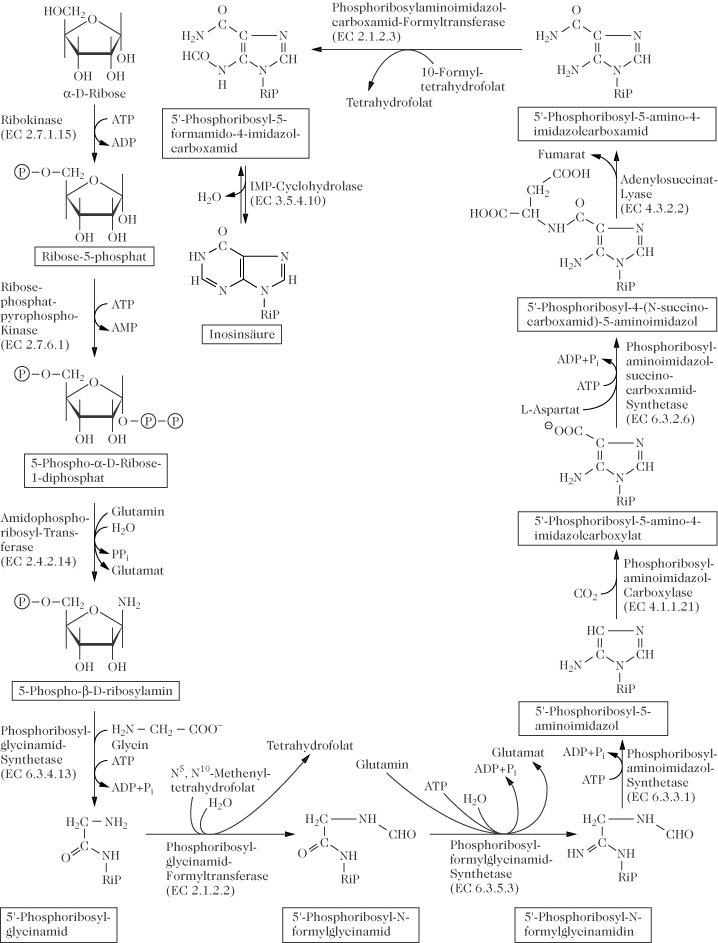
Abb. 1 zeigt dass wesentliche Teile des Puringerüsts aus den Aminosäuren Glycin, Aspartat und Glutamin stammen, in Abb. 2 sind die einzelnen Stoffwechselschritte dargestellt.
α-D-Ribose-5-phosphat wird pyrophosphoryliert zu 5-Phosphoribosyl-1-pyrophosphat. Die Pyrophosphatgruppe wird anschließend durch eine Aminogruppe ersetzt, welche aus der Amidgruppe von L-Glutamin übertragen wird. Der Stickstoff dieser Gruppe ist für das N9 des Purinringsystems vorgesehen. Die Ribosephosphatgruppe bleibt während der nachfolgenden enzymatisch katalysierten Stufen gebunden, die letztendlich zum vollständigen Purinringsystem führen. Die Purine werden also in Form ihrer Nucleosidmonophosphate synthetisiert. Das erste Produkt mit einem vollständigen Purinringsystem ist die Inosinsäure (Inosin-5’-monophosphat, IMP), sie ist Ausgangspunkt für die Synthese der Purinnucleotide Adenosin-5'-monophosphat (AMP) und Guanosin-5'-monophosphat (GMP) durch sog. Interkonversion.
Die Nucleosidmonophosphate werden durch zwei Kinase-Reaktionen in die Triphosphate (die direkten Vorstufen von RNA) überführt. Diese Kinasen sind wenig spezifisch. Sie katalysieren die Phosphorylierung von Adenin-, Guanin-, aber auch von Pyrimidinnucleotiden.
Die P. wird durch beide Endprodukte, AMP und GMP, reguliert, die beide die Phosphoribosylpyrophosphat-Amidotransferase (EC 2.4.2.14) gemeinsam inhibieren. GMP inhibiert ferner die IMP-Dehydrogenase (EC 1.2.1.14), AMP die Adenylsuccinat-Synthetase (EC 6.3.4.4). Die Biosynthese von AMP und GMP wird auch reguliert durch die wechselseitige Abhängigkeit der GMP-Biosynthese von ATP und der AMP-Synthese von GTP. ATP inhibiert die GMP-Reduktase, die in einem Schritt GMP in IMP umwandelt.
Purinbiosynthese: Abb. 1. Purin-Grundstruktur und die Anteile von Aminosäuren im Verlauf der Biosynthese.
Purinbiosynthese: Abb. 2. Bildung des Purinringsystems bis zur Inosinsäure.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.