Nanooptik: Lichtmikroskopie auf molekularer Ebene
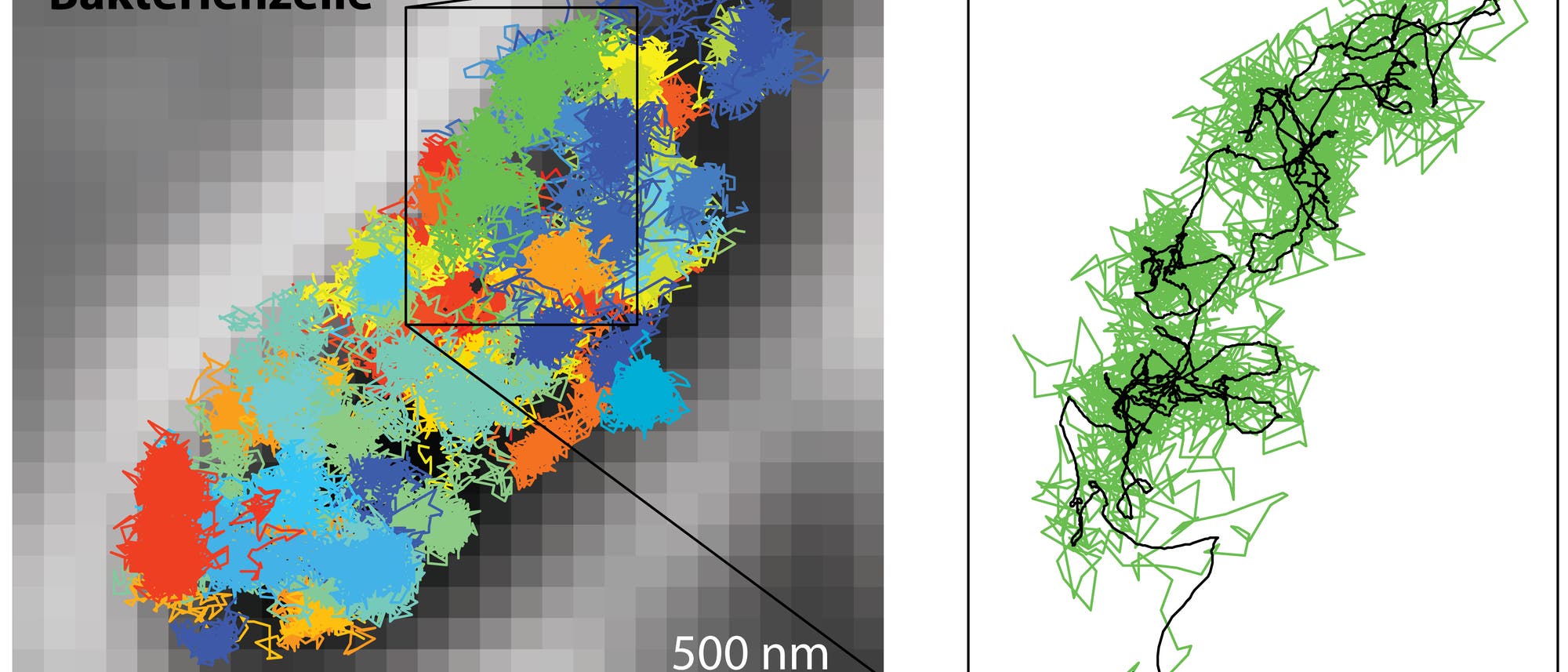
Bis vor etwa zwei Jahrzehnten waren sich die meisten Experten einig: Die Wellennatur des Lichts beschränkt die mögliche Auflösung optischer Mikroskope. Strukturen kleiner als die halbe Wellenlänge des sichtbaren Lichts – das ergibt rund 200 Nanometer – lassen sich nicht als getrennt voneinander wahrnehmen. Der Physiker Ernst Abbe hatte diese Gesetzmäßigkeit 1873 formuliert. Konventionelle Lichtmikroskope können daher zwar Zellen und deren Organellen darstellen, doch deutlich kleinere Details wie beispielsweise einzelne Proteine oder molekulare Prozesse bleiben ihnen verborgen. In jene Bereiche dringen nur alternative Techniken wie die Elektronenmikroskopie vor, mit denen aber lebende Zellen kaum mehr beobachtbar sind. Die Einschränkung war für Biologen ein großes Problem.
Um die Jahrtausendwende entwickelte Stefan Hell mit seinen Kollegen vom Max-Planck-Institut für biophysikalische Chemie in Göttingen einen raffinierten Trick. Ihre damals unter dem Akronym STED (stimulated emission depletion) vorgestellte Methode überwand die Abbe-Grenze fundamental. Mit ihr ist es heute möglich, zehnmal kleinere Strukturen in der Größenordnung von 20 Nanometern darzustellen – sogar in lebenden Organismen. STED und ähnliche Verfahren werden unter dem Sammelbegriff der superauflösenden Fluoreszenzmikroskopie zusammengefasst. 2014 erhielt Hell gemeinsam mit zwei weiteren Forschern den Nobelpreis für Chemie für die Einleitung einer neuen Ära der Lichtmikroskopie. Ein Team um Hell stellte nun die Technik MINFLUX (minimal emission fluxes) vor, welche die Auflösung erneut etwa um das Zehnfache steigert. Sie ermöglicht Werte von einem Nanometer, das entspricht der Größe der einzelnen Farbstoffmoleküle ...
Schreiben Sie uns!
Beitrag schreiben