Login erforderlich
Dieser Artikel ist Abonnenten mit Zugriffsrechten für diese Ausgabe frei zugänglich.
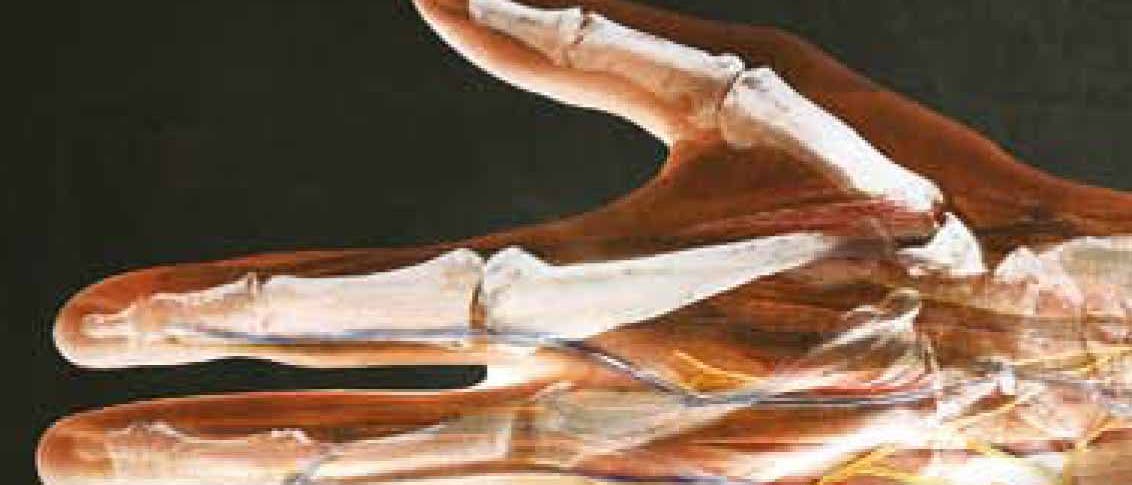
Regeneration: Könnten menschliche Gliedmaßen nachwachsen?
Ein amputiertes Bein komplett regenerieren – für Molche und Salamander ist das kein Problem. Forscher hoffen von ihnen zu lernen, wie das auch beim Menschen gelingen könnte.
© Aaron Goodman (Ausschnitt)
Die Gliedmaßen eines Molchs oder Salamanders mögen kleiner und ein wenig glitschiger sein als die des Menschen. In ihrem Aufbau jedoch sind sie ähnlich: außen Haut und innen Knochen, Muskeln, Bändern, Sehnen, Nerven und Blutgefäße, zusammengehalten durch einen lockeren Verbund von Bindegewebszellen, der dem Ganzen Kontur gibt. Nichts Aufregendes also, sollte man meinen – aber unter Wirbeltieren sind die Beine der Schwanzlurche, zu denen Molche und Salamander gehören, etwas ganz Besonderes. Denn nach einer Amputation wachsen die Gliedmaßen komplett wieder nach, und das selbst beim geschlechtsreifen Tier.
Schon den Froschlurchen – der nächsthöheren Wirbeltiergruppe mit den Kröten und Fröschen – gelingt dies nur als Kaulquappe, wenn sie ihre Beinchen entwickeln. Selbst ein Säugetierembryo kann seine so genannten Extremitätenknospen noch in gewissem Umfang regenerieren, diese Fähigkeit schwindet aber bereits lange vor der Geburt. Grob gesehen lässt die Regenerationsfähigkeit gewöhnlich mit fortschreitender individueller wie evolutionärer Entwicklung nach.
Wie ein "niederer" Schwanzlurch das Kunststück fertigbringt, zeit seines Lebens komplexe Körperteile nachwachsen zu lassen, interessiert Forscher schon lange. Woher "weiß" der gerade nachwachsende Abschnitt eines Glieds, wie viel von dem Ganzen verloren gegangen und nun zu ersetzen ist? Warum bildet die Haut keine Narbe, die den Stumpf beispielsweise beim Menschen definitiv versiegelt? Wie kann ein Schwanzlurch so spät noch auf embryonale Programme zurückgreifen, um ein Bein immer wieder von Grund auf neu entstehen zu lassen? Antworten darauf kristallisieren sich inzwischen heraus. Sobald wir verstanden haben, wie diese natürliche Regeneration funktioniert, können wir sie vielleicht – so die Hoffnung – eines Tages auch künstlich beim Menschen auslösen. Das lohnende Ziel immerhin lautet, aus einer Amputationswunde das nun Fehlende nachwachsen zu lassen und die Heilung anderer größerer Verletzungen zu revolutionieren.
Die Reaktion des menschlichen Gewebes auf schwere Verletzungen unterscheidet sich anfänglich kaum von der eines Schwanzlurchs, doch schon wenig später zeigen sich deutliche Abweichungen. Bei unserer Spezies kommt es nämlich im Zuge der Wundheilung zur Vernarbung des Gewebes, was letztlich eine Regeneration verhindert. Dennoch gibt es Anzeichen, dass auch im menschlichen Organismus durchaus noch das Potenzial schlummert, komplexe Körperteile wiederherzustellen. Man müsste es anzapfen und die menschliche Wundheilung lurchähnlicher machen können. Wie sich dies bewerkstelligen ließe, versuchten wir zunächst am Vorbild der natürlichen Experten zu studieren.
Wird einem Schwanzlurch ein Beinchen amputiert (bei all solchen Experimenten werden die Tiere narkotisiert), ziehen sich die Blutgefäße im Stumpf schnell zusammen, um den Blutverlust gering zu halten. Dann überwandern Oberhautzellen die Schnittfläche, decken sie zügig ab. Innerhalb der ersten Tage nach der Verletzung verwandelt sich diese so genannte Wundepidermis in eine kappenartige Schicht von Signalzellen, die für eine erfolgreiche Regeneration unverzichtbar ist. In der Zwischenzeit lösen sich aus dem Maschenwerk des Bindegewebes einige seiner Erzeugerzellen und wandern der Amputationsfläche entlang ins Zentrum der Wunde. Dort vermehren sie sich und bilden ein Regenerationsblastem – eine knubbelige Anhäufung von Zellen mit Stammzellcharakter, die als Vorläuferzellen für das künftige neue Beinchen dienen.
Ein fünftes Bein
Ein klassisches Studienobjekt hierfür ist der Axolotl, ein Querzahnmolch. Schon vor Jahren wies die Arbeitsgruppe von Susan V. Bryant an der University of California in Irvine nach, dass die Blastemzellen des Tiers den Zellen der embryonalen Extremitätenknospe entsprechen. Anscheinend handelte es sich bei der Regeneration eines Beins praktisch um die Rekapitulation eines embryonalen Prozesses. Demnach sollte beiden Vorgängen das gleiche genetische Programm zu Grunde liegen. Und da der Mensch seine Extremitäten ebenfalls in der Embryonalphase ausbildet, würde auch er im Prinzip bereits über die nötigen Grundprogramme zur Regeneration von Gliedmaßen verfügen. Kurzum: Es schien, als müssten die Forscher nur noch herausfinden, wie man nach einer Amputation die Bildung eines Blastems in Gang setzt.
Eben das versuchte einer von uns (Gardiner) vor wenigen Jahren zusammen mit Tetsuya Endo an dieser Universität. Wir wählten einen stark vereinfachten Ansatz: Statt von echten Amputationsflächen, in denen ein Axolotl natürlicherweise ein Blastem ausbildet, gingen wir von einer kleinen, am Bein angebrachten Hautwunde aus, die eigentlich durch Regeneration der Haut ausheilt. Dahinter stand die Idee, dass solch eine harmlose Wunde beim Schwanzlurch insofern den Amputationsverletzungen bei Säugern ähnelt, als sich an ihr normalerweise auch keine neue Gliedmaße bildet. Man kann aber beim Axolotl ein zusätzliches Bein dort wachsen lassen, wo sonst bloß eine einfache Wundheilung abläuft, und das ermöglichte uns, den Regenerationsprozess und seine Voraussetzungen feiner zu analysieren.
Wie bei einer Amputationswunde wurde auch die kleine ausgeschnittene Hautfläche am Bein rasch von einwandernden Zellen der Oberhaut (der Epidermis) überdeckt und versiegelt...
Schon den Froschlurchen – der nächsthöheren Wirbeltiergruppe mit den Kröten und Fröschen – gelingt dies nur als Kaulquappe, wenn sie ihre Beinchen entwickeln. Selbst ein Säugetierembryo kann seine so genannten Extremitätenknospen noch in gewissem Umfang regenerieren, diese Fähigkeit schwindet aber bereits lange vor der Geburt. Grob gesehen lässt die Regenerationsfähigkeit gewöhnlich mit fortschreitender individueller wie evolutionärer Entwicklung nach.
Wie ein "niederer" Schwanzlurch das Kunststück fertigbringt, zeit seines Lebens komplexe Körperteile nachwachsen zu lassen, interessiert Forscher schon lange. Woher "weiß" der gerade nachwachsende Abschnitt eines Glieds, wie viel von dem Ganzen verloren gegangen und nun zu ersetzen ist? Warum bildet die Haut keine Narbe, die den Stumpf beispielsweise beim Menschen definitiv versiegelt? Wie kann ein Schwanzlurch so spät noch auf embryonale Programme zurückgreifen, um ein Bein immer wieder von Grund auf neu entstehen zu lassen? Antworten darauf kristallisieren sich inzwischen heraus. Sobald wir verstanden haben, wie diese natürliche Regeneration funktioniert, können wir sie vielleicht – so die Hoffnung – eines Tages auch künstlich beim Menschen auslösen. Das lohnende Ziel immerhin lautet, aus einer Amputationswunde das nun Fehlende nachwachsen zu lassen und die Heilung anderer größerer Verletzungen zu revolutionieren.
Die Reaktion des menschlichen Gewebes auf schwere Verletzungen unterscheidet sich anfänglich kaum von der eines Schwanzlurchs, doch schon wenig später zeigen sich deutliche Abweichungen. Bei unserer Spezies kommt es nämlich im Zuge der Wundheilung zur Vernarbung des Gewebes, was letztlich eine Regeneration verhindert. Dennoch gibt es Anzeichen, dass auch im menschlichen Organismus durchaus noch das Potenzial schlummert, komplexe Körperteile wiederherzustellen. Man müsste es anzapfen und die menschliche Wundheilung lurchähnlicher machen können. Wie sich dies bewerkstelligen ließe, versuchten wir zunächst am Vorbild der natürlichen Experten zu studieren.
Wird einem Schwanzlurch ein Beinchen amputiert (bei all solchen Experimenten werden die Tiere narkotisiert), ziehen sich die Blutgefäße im Stumpf schnell zusammen, um den Blutverlust gering zu halten. Dann überwandern Oberhautzellen die Schnittfläche, decken sie zügig ab. Innerhalb der ersten Tage nach der Verletzung verwandelt sich diese so genannte Wundepidermis in eine kappenartige Schicht von Signalzellen, die für eine erfolgreiche Regeneration unverzichtbar ist. In der Zwischenzeit lösen sich aus dem Maschenwerk des Bindegewebes einige seiner Erzeugerzellen und wandern der Amputationsfläche entlang ins Zentrum der Wunde. Dort vermehren sie sich und bilden ein Regenerationsblastem – eine knubbelige Anhäufung von Zellen mit Stammzellcharakter, die als Vorläuferzellen für das künftige neue Beinchen dienen.
Ein fünftes Bein
Ein klassisches Studienobjekt hierfür ist der Axolotl, ein Querzahnmolch. Schon vor Jahren wies die Arbeitsgruppe von Susan V. Bryant an der University of California in Irvine nach, dass die Blastemzellen des Tiers den Zellen der embryonalen Extremitätenknospe entsprechen. Anscheinend handelte es sich bei der Regeneration eines Beins praktisch um die Rekapitulation eines embryonalen Prozesses. Demnach sollte beiden Vorgängen das gleiche genetische Programm zu Grunde liegen. Und da der Mensch seine Extremitäten ebenfalls in der Embryonalphase ausbildet, würde auch er im Prinzip bereits über die nötigen Grundprogramme zur Regeneration von Gliedmaßen verfügen. Kurzum: Es schien, als müssten die Forscher nur noch herausfinden, wie man nach einer Amputation die Bildung eines Blastems in Gang setzt.
Eben das versuchte einer von uns (Gardiner) vor wenigen Jahren zusammen mit Tetsuya Endo an dieser Universität. Wir wählten einen stark vereinfachten Ansatz: Statt von echten Amputationsflächen, in denen ein Axolotl natürlicherweise ein Blastem ausbildet, gingen wir von einer kleinen, am Bein angebrachten Hautwunde aus, die eigentlich durch Regeneration der Haut ausheilt. Dahinter stand die Idee, dass solch eine harmlose Wunde beim Schwanzlurch insofern den Amputationsverletzungen bei Säugern ähnelt, als sich an ihr normalerweise auch keine neue Gliedmaße bildet. Man kann aber beim Axolotl ein zusätzliches Bein dort wachsen lassen, wo sonst bloß eine einfache Wundheilung abläuft, und das ermöglichte uns, den Regenerationsprozess und seine Voraussetzungen feiner zu analysieren.
Wie bei einer Amputationswunde wurde auch die kleine ausgeschnittene Hautfläche am Bein rasch von einwandernden Zellen der Oberhaut (der Epidermis) überdeckt und versiegelt...

Schreiben Sie uns!
Beitrag schreiben