News: Bild oder Spiegelbild?
In einem neuseeländischen Meeres-Schwamm entdeckten Forscher vor drei Jahren einen potenziellen Wirkstoff gegen Krebs. Nun gelang anderen Wissenschaftlern die Synthese des Moleküls - allerdings nur in der spiegelbildlichen, pharmakologisch unwirksamen Form. Immerhin erfuhren sie so auch einiges über das natürliche Molekül.
© (Ausschnitt)
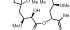
Naturstoffe sind häufig kompliziert aufgebaute Kohlenstoff-Verbindungen. Während deren Grobstruktur trotzdem relativ leicht zu analysieren ist, gestaltet sich die Aufklärung der genauen räumlichen Verhältnisse oft als extrem schwierig. Einer der Gründe ist die räumliche Anordnung der vier "Bindungsarme" von Kohlenstoffatomen, die in die vier Ecken eines Tetraeders weisen. Vier verschiedene Bindungspartner können so auf zwei unterschiedliche Arten angeordnet sein, die sich zueinander verhalten wie Bild und Spiegelbild.
Pelurosid A enthält zehn dieser so genannten chiralen Zentren. Vor etwa drei Jahren isolierten Wissenschaftler um Peter Northcote diese bis dato unbekannte Verbindung aus einem neuseeländischen Meeres-Schwamm. Schnell erwies sich Pelurosid A als potenzieller Wirkstoff gegen Krebs, denn die Verbindung zeigt einen ähnlichen Wirkmechanismus wie Taxol und könnte dieses in der Chemotherapie ergänzen.
Chemiker um Xibin Liao vom University of Texas Southwestern Medical Center wollten die Struktur von Pelurosid A nun genauer erkunden. Zwar konnte bereits die Ausrichtung der einzelnen chiralen Zentren zueinander ermittelt werden, unklar blieb dagegen die absolute Konfiguration der einzelnen Zentren. Denn ein und dieselbe "relative Struktur" kann sich in Form zweier zueinander spiegelbildlicher, aber ansonsten identischer Moleküle manifestieren.
Liao und seine Kollegen griffen, wie es Chemiker in solchen schwierigen Fällen zu tun pflegen, auf die Methode der Totalsynthese zurück: Sie tüftelten einen Weg aus, wie sich der Naturstoff aus Molekül-Bausteinen nachbauen lässt. Anhand des Syntheseweges ist festgelegt, welches der beiden Spiegelbilder entsteht. Ein Vergleich der spektroskopischen Daten der erhaltenen Verbindung mit denen des natürlichen Pelorusids A zeigte Übereinstimmung. Das bedeutet zunächst, dass das synthetische Pelorusid A die richtige relative Struktur aufweist, die damit nun auch belegt ist. Aber ist es auch das richtige Spielgelbild?
Leider nein, mussten die Chemiker feststellen: Die synthetische Verbindung dreht die Ebene linear polarisierten Lichts nach links und damit in die entgegengesetzte Richtung wie der rechtsdrehende Naturstoff. Damit ist aber zumindest eindeutig geklärt, in welcher Konfiguration Pelorusid A in der Natur vorkommt. Klar, woran die texanische Gruppe nun mit Hochdruck arbeitet – der Totalsynthese des anderen Spiegelbildes, denn nur dieses ist pharmakologisch wirksam.
Pelurosid A enthält zehn dieser so genannten chiralen Zentren. Vor etwa drei Jahren isolierten Wissenschaftler um Peter Northcote diese bis dato unbekannte Verbindung aus einem neuseeländischen Meeres-Schwamm. Schnell erwies sich Pelurosid A als potenzieller Wirkstoff gegen Krebs, denn die Verbindung zeigt einen ähnlichen Wirkmechanismus wie Taxol und könnte dieses in der Chemotherapie ergänzen.
Chemiker um Xibin Liao vom University of Texas Southwestern Medical Center wollten die Struktur von Pelurosid A nun genauer erkunden. Zwar konnte bereits die Ausrichtung der einzelnen chiralen Zentren zueinander ermittelt werden, unklar blieb dagegen die absolute Konfiguration der einzelnen Zentren. Denn ein und dieselbe "relative Struktur" kann sich in Form zweier zueinander spiegelbildlicher, aber ansonsten identischer Moleküle manifestieren.
Liao und seine Kollegen griffen, wie es Chemiker in solchen schwierigen Fällen zu tun pflegen, auf die Methode der Totalsynthese zurück: Sie tüftelten einen Weg aus, wie sich der Naturstoff aus Molekül-Bausteinen nachbauen lässt. Anhand des Syntheseweges ist festgelegt, welches der beiden Spiegelbilder entsteht. Ein Vergleich der spektroskopischen Daten der erhaltenen Verbindung mit denen des natürlichen Pelorusids A zeigte Übereinstimmung. Das bedeutet zunächst, dass das synthetische Pelorusid A die richtige relative Struktur aufweist, die damit nun auch belegt ist. Aber ist es auch das richtige Spielgelbild?
Leider nein, mussten die Chemiker feststellen: Die synthetische Verbindung dreht die Ebene linear polarisierten Lichts nach links und damit in die entgegengesetzte Richtung wie der rechtsdrehende Naturstoff. Damit ist aber zumindest eindeutig geklärt, in welcher Konfiguration Pelorusid A in der Natur vorkommt. Klar, woran die texanische Gruppe nun mit Hochdruck arbeitet – der Totalsynthese des anderen Spiegelbildes, denn nur dieses ist pharmakologisch wirksam.

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.