Zellbiologie: Die Nano-Tunnel der Zellen
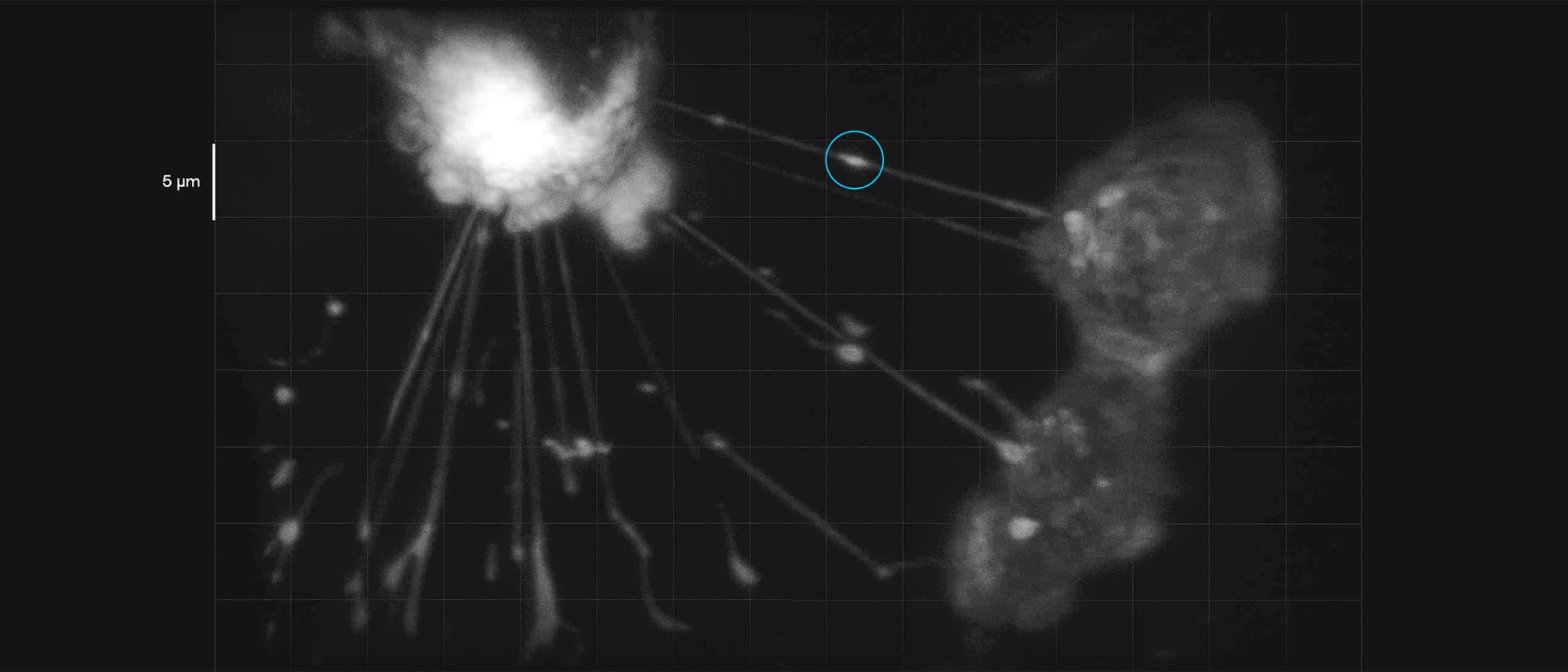
Vor rund zehn Jahren, als Assistent in der Onkologie am Sloan Kettering Cancer Center in New York, war Emil Lou gelegentlich beunruhigt, wenn er mit dem Mikroskop seine Krebszellkulturen durchmusterte: Regelmäßig konnte der Arzt und Forscher »lange, dünne, durchsichtige Linien« ausmachen, jede davon etwa 50 Nanometer breit und 150 bis 200 Mikrometer lang. Die Krebszellen schienen sich über diese Linien miteinander zu verbinden. Lou konnte sich darauf keinen Reim machen – genauso wie alle Zellbiologie-Koryphäen, die an seinem Institut arbeiteten und einen Blick auf den Fund warfen. Lou warf sich in eine tiefschürfende Literaturrecherche – und stieß schließlich auf eine Veröffentlichung aus dem Jahr 2004 im Journal »Science«: Das Team von Hans-Hermann Gerdes von der Universität Heidelberg hatte ganz ähnliche Strukturen zwischen Zellen beschrieben und als »Nanoröhrchen-Autobahnen« und »tunnelnde Nanoröhren«, kurz TNTs bezeichnet.
Zunächst hatte Lou aber noch Zweifel, ob seine Linien wirklich etwas zu bedeuten hatten: Er machte sich in archivierten Tumorzelllinien von Patienten des Krebszentrums auf die Suche – und stieß hier tatsächlich auf die gleichen Zellstrukturen. Seitdem hat Lou – später als Forscher an der Universität Minnesota - allerlei Hinweise darauf zusammengetragen, dass Tumorzellen sich tatsächlich über TNTs verbinden, um kurze regulatorische RNA-Stückchen, so genannte microRNAs, auszutauschen. Sie versetzen Krebszellen in die Lage, Resistenzmechanismen gegen Chemotherapeutika an Nachbarzellen zu übertragen.

Wie konnten diese Kommunikationstunnel nur derart lange unbemerkt bleiben? Lou erklärt es sich damit, dass die Krebsforschung während der vergangenen Jahrzehnte vor allem an Mutationen und Therapien gegen ihre Folgen interessiert war. Strukturen zwischen Krebszellen gingen dabei unter: »Eigentlich liegen sie dir direkt vor der Nase – aber wenn man nach was anderem schaut, übersieht man sie halt«, sagt Lou.
Seit ein paar Jahren jedoch weitet sich Fokus der Wissenschaftler, und immer mehr erforschen heute die Funktion von TNTs. Ihre Ergebnisse zeigen, dass die Nanoröhren nicht nur microRNAs zwischen Zellen hin und her transportieren, sondern auch messengerRNAs, Proteine, Viren und sogar ganze Organellen, darunter Lysosomen und Mitochondrien. »Und das ist erst die Spitze des Eisbergs«, sagt Lou.
Die fragilen Zellbrücken tauchen nicht nur in Krebszellen, bei Aids oder neurodegenerativen Erkrankungen auf, sondern auch während der normalen embryonalen Entwicklung. Gesunde Zellen bilden dagegen im Regelfall keine TNTs – bis sie unter Stress geraten und eine Art biochemischen Hilferuf an die Nachbarn senden. Unklar ist weiter, wie die Nachbarn den Ruf wahrnehmen – und woher sie »wissen«, welche Hilfslieferung sie über die aufgebauten Zelltunnel in Richtung Notfall schicken sollen.
Sehen ist glauben
Die Entdeckung der TNTs war letztlich ein glücklicher Zufall. Amin Rustom, damals Mitglied in der Gruppe von Gerdes (heute leitet er in Heidelberg seine eigene Gruppe) hatte einen neuen Fluoreszenzfarbstoff ausprobiert, um bestimmte zelluläre Strukturen zu markieren. Eigentlich hätte das Protokoll für die Verwendung des Farbstoffs nun mehrere aufeinanderfolgende Waschschritte vorgesehen – die Rustom aber übersprang, um dann trotzdem seine Rattenhirnzellen unter dem Mikroskop zu mustern. Nun fielen ihm lange röhrenartige Strukturen auf, die der Farbstoff sichtbar gemacht hatte. Die Waschschritte hätten die Röhren dagegen wahrscheinlich zerstört, meint er.
Rustom und seine Kollegen untersuchten die bizarren Strukturen nun genauer: Offenbar handelte es sich um offene Tunnel, durch die Organellen und Membranvesikel von einer Zelle zur nächsten wandern. Nach und nach wurde den Forschern klar, dass sie einen völlig neuen Mechanismus der Zell-zu-Zell-Kommunikation entdeckt hatten. Andere Forscher blieben allerdings skeptisch. Sie vermuteten, dass die TNTs Folge experimenteller Artefakte und keine natürlich vorkommenden Strukturen waren. Die massiven Zweifel sorgten dafür, dass es vier oder fünf Jahre dauerte, bis die Gruppe ihren Fund in »Science« veröffentlichen konnte.
Bis heute ist nicht völlig sicher, ob TNTs tatsächlich der interzellulären Kommunikation dienen. Zellen haben andere Möglichkeiten, Moleküle auszutauschen: Am bekanntesten sind hier die als Gap Junctions und Exosomen bezeichneten Strukturen. Gap Junctions sind so etwas wie Türen zwischen benachbarten Räumen - die Zellmembran durchspannende, verschließbare Öffnungen. Exosomen sind dagegen aus Zellmembranen gebildete kleine Kugeln (Vesikel), die von den Zellen abgeschnürt werden. Lange galten sie als zelluläre Müllsäcke, heute werden sie eher als Vehikel verstanden, die microRNAs und andere Signalmoleküle zwischen teils weit entfernten Zellen transportieren. TNTs ähneln dagegen längeren, geschlossenen Brückenelementen für Fußgänger, die separate Gebäude verbinden.
Welche Aufgabe die TNTs bei der Zellkommunikation haben, lässt sich nur mit Mühe herausarbeiten: Es ist schwierig, bei Experimenten nur einen der verschiedenen Kommunikationskanäle lahmzulegen, ohne gleichzeitig die anderen zu stören. TNT-Forscher suchen derzeit vor allem nach spezifischen Biomarkern für die Nanoröhren, um sie besser von ähnlich aussehenden Strukturen wie den Filopodien unterscheiden zu können. Diese sind selbst lange zelluläre Auswüchse, die Zellen zum Tasten und zur Fortbewegung nutzen. Zwar werden Filopodien nicht beliebig lang, und sie transportieren auch keine Güter von einer Zelle zur anderen. An ihrer Form allein aber kann man sie kaum von TNTs unterscheiden.
Erschwerend kommt hinzu, dass TNTs in einer Vielzahl von Zelltypen und Größen vorkommen und morphologisch vielfältig sind - manche sind so groß, dass sie eher als Mikro- statt als Nanoröhen durchgehen. Und einige Forscher vermuten, dass sich TNTs funktionell von Mikroröhrchen unterscheiden. Im Augenblick ist man also noch damit beschäftigt, die verschiedenen Subtypen von Nano- und Mikroröhrchen genauer zu charakterisieren.
Verständlicherweise sehen viele Wissenschaftler die Hypothesen zur Funktionsweise der TNTS recht skeptisch. Auch Chiara Zurzolo, Leiterin der Zellbiologie-Abteilung am Institut Pasteur in Paris und selbst TNT-Forscherin, wundert das nicht: TNTs seien »ja noch nicht einmal wirklich umfassend beschrieben – wie kann ich an etwas glauben, das alles sein könnte?«
Immerhin, allmählich tröpfeln fassbare Erkenntnisse herein. Das Forschungsfeld profitiert dabei von technischen Fortschritten in der Mikroskopie und verwandten Methoden. So erforscht Ian Smith von der University of California in Irvine TNTs mit einer neuen Variante der Lichtscheibenmikroskopie – einem bildgebenden Verfahren, das schonend genug ist, lebende Zellen über Stunden oder sogar Tage zu beobachten. Damit gelingt es seinem Team, die empfindlichen TNTs in lebenden Zellen zu filmen und einzelne transportierte Moleküle zu verfolgen. »Sehen zu können, was ich erforsche, war für mich schon immer das, was mich zur Mikroskopie getrieben hat«, sagt Smith.
Auf den interzellulären Transfer von RNA hat sich auch Gal Haimovich spezialisiert. Heute arbeitet er am Weizmann-Institut für Wissenschaften in Israel. Im Jahr 2012 aber hatte er gerade eine Stelle als Postdoktorand im Labor von Robert Singer am Albert Einstein College of Medicine in New York angenommen. Damals besagte das Standardmodell des RNA-Transfers, dass die Moleküle immer nur passiv von einer Zelle zur anderen diffundieren, umhüllt von Exosomen. Das war zwar nie direkt beobachtet worden; die Hypothese hatte sich aber direkt aus den Ergebnissen biochemischer Experimente ergeben und war allgemein akzeptiert.
Haimovich jedoch setzte die in Singers Labor entwickelten bildgebenden Verfahren ein, um RNA während des Transports zu visualisieren und bessere quantitative Daten über den Transfer zu sammeln. Also züchtete er zwei Zellstämme in derselben Kulturschale, von denen aber nur einer eine bestimmte mRNA herstellen konnte. Als Haimovich die reifen Doppelkulturen unters Mikroskop legte, wanderten die RNA-Moleküle vor seinen Augen über TNTs von den Zellen des produzierenden Stamms zu jenen nicht herstellenden Zellen. »Ich konnte die mRNA tatsächlich in den Nanoröhrchen sehen«, sagt Haimovich. »Als ich dann die Bildung von Membrannanoröhrchen hemmte, ... brach der Transfer zusammen.«
Aber steuerten die Zellen den RNA-Transfer auch aktiv, anders als das Standardmodell es behauptete? Um das herauszufinden, unterzog Haimovich die Zellen entweder Hitzeschocks oder oxidativem Stress. Tatsächlich beobachtete er, dass sich die Übertragungsrate bei oxidativem Stress erhöhte, während sie bei Hitzeschocks abnahm, »ein Hinweis darauf, dass es sich um einen biologisch regulierten Mechanismus handelt und nicht um zufällige Diffusion von RNA«, sagt er. Allerdings setzte der Effekt nur ein, wenn er ausschließlich die nicht produzierenden Zellen stresste. »Das deutet darauf hin, dass gestresste Akzeptorzellen von ihren Spenderzellen mRNA aktiv anfordern«, sagt Haimovich. Diese Ergebnisse veröffentlichte er im vergangenen Jahr im Fachblatt »PNAS«.
TNTs bei Krebs
Krebszellen, die sich sehr rasch immer wieder teilen, sind oft gestresst: Sie müssen sich mit Sauerstoffmangel, Nährstoffmangelerscheinungen und oxidativem Stress auseinandersetzen. Da überrascht es nicht, dass auch sie TNTs bilden: Emil Lou konnte zeigen, dass verschiedene Krebszellen zwischen fünf- und 100-mal so viele TNTs erzeugen wie gesunde erwachsene Zellen. Und Frank Winkler, Neurologe und Krebsforscher an der Universität Heidelberg, hat herausgefunden, dass Gliome (eine Art von Hirntumor) voller Tumor-Microtubes sind - den großen Brüdern der TNTs.
Die Röhren zwischen Tumorzellen waren Winkler im Gehirn lebender Mäuse aufgefallen. Aber ihre Bedeutung war ihm nicht sofort aufgegangen. Ein Pathologe, mit dem er zusammenarbeitete, führte die Beobachtung anfangs auf Fehler beim Erstellen der Präparate zurück. Erst als die beiden Forscher die winzigen Röhren auch in Zellkulturen fanden, wurde ihnen klar, dass sie kein Artefakt waren. »Als wir wussten, wonach wir suchen mussten, bemerkten wir, was für ein auffälliges Merkmal von Tumoren diese Röhren sind«, sagt Winkler.
In späteren Experimenten konnte er nachweisen, dass bei einer Chemotherapie oder Bestrahlung isolierte Krebszellen sterben – während Zellen, die mit Tumor-Microtubes oder TNTs verbunden sind, überleben. Die vernetzten Krebszellen sind »das Rückgrat der Krankheit«, so Winkler: Auf den Stress der Chemo- oder Strahlentherapie reagierten die schadhaften Zellen mit der Bildung zusätzlicher Tumor-Microtubes, was ihr Netzwerk weiter stärkte.
Mit Ansätzen aus der Netzwerkforschung arbeiten Winkler und sein Team heute daran, die Kommunikationsmuster zwischen Krebszellen zu entschlüsseln. Seiner Arbeitshypothese zufolge gibt es in Tumornetzwerken eine Kommunikationshierarchie, in der bestimmte Zellen als Steuerungsknoten fungieren. Diese Zellen weisen andere womöglich an, sich auf eine bestimmte Art zu verhalten: So könnten sie das Wachstum des Tumors und seine Resistenz gegen Therapien kontrollieren.
Winklers Gruppe konnte auch zeigen, dass Gliomtumorzellen sogar Verbindungen zu benachbarten gesunden Zellen aufnehmen – was immerhin denkbar erscheinen lässt, dass hier eine wechselseitige Kommunikation mit dem Hirngewebe erfolgt. Die pädiatrischen Onkologin Michelle Monje von der Stanford University hatte bereits belegen können, dass die Aktivität der Nervenzellen des Gehirns das Wachstums der Gliazellentumore fördert – und Winkler vermutet nun, dass Tumor-Microtubes und TNTs dabei eine zentrale Rolle spielen. »Der Tumor beeinflusst das Gehirn, und das Gehirn beeinflusst den Tumor«, sagt er. »Das ist ein geradezu erschreckendes Maß an Komplexität.«
Die gute Nachricht sei aber, dass Mikro- und Nanoröhrchen zugleich ganz neue therapeutische Angriffspunkte liefern könnten. »Das wäre meine große Hoffnung – neben dem Wunsch, diese ganze verrückte Biologie einmal zu durchschauen«, sagt Winkler.
Ein Ansatz wäre, sich auf die Suche nach Wirkstoffen zu machen, die die Bildung von Mikro- und Nanoröhrchen hemmen – und so Krebs für die Chemo- und Strahlentherapie anfälliger machen. Eine andere Strategie könnte sein, die röhrenförmigen Netzwerke zur Verteilung von Wirkstoffen zu nutzen. Darauf setzt eine Therapie, die die amerikanische Gesundheitsbehörde FDA 2015 genehmigt hat: Ein onkolytisches Virus, das eine Form der Gentherapie für Melanompatienten erlaubt. Emil Lou hatte herausgefunden, dass dieses therapeutische Virus über TNTs von Zelle zu Zelle wandert.
Auch der Pharmariese GlaxoSmithKline wittert auf diesem Forschungsfeld nun Gelegenheiten: Im September 2016 rief der Konzern Experten zu einem Meeting, um die Forschung an TNTs voranzutreiben – und herauszufinden, wie man sie chemotherapeutisch sinnvoll hemmen oder fördern könnte.
Eine neue Trickkiste für Immunzellen
Im Immunsystem scheinen TNTs ebenfalls eine wichtige Rolle zu spielen. So etwa in dendritischen Zellen, die Robbie Mailliard, Immunologe an der Universität Pittsburgh, als Spielmacher des Immunsystems umschreibt: Sie verbinden sich bei einer Immunantwort über TNTs, ein Prozess, der als Retikulation bezeichnet wird. »Das passiert so schnell und auf so dramatische Weise, als wären die Zellen ein Haufen kleiner Spidermans, die gemeinsame Netze in die Gegend schleudern«, schildert Mailliard. »Dabei verbrauchen sie in sehr kurzer Zeit eine Menge Energie. Deshalb denke ich, dass diese Netze einen wichtigen Zweck erfüllen.«
Gemeinsam mit seinen Kollegen Giovanna Rappocciolo und Charles Rinaldo hat Mailliard herausgefunden, dass HIV und andere Viren sich entlang von TNTs unter dendritischen Zellen verbreiten. Als sie die TNTs hemmten, schien dies dann auch die Verbreitung von HIV zu unterdrücken. Darüber hinaus beobachteten die Forscher, dass so genannte »Langzeit-Nonprogressoren« - jene extrem seltenen HIV-Infizierten, die das Virus ohne antiretrovirale Therapie kontrollieren - einen genetischen Defekt aufweisen, der den Cholesterinstoffwechsel der dendritischen Zellen verändert. Gleichzeitig sorgt dies dafür, dass sie TNTs nicht mehr richtig ausbilden können. Derzeit untersuchen Maillard und seine Kollegen folgerichtig, ob Medikamente, die üblicherweise zur Senkung des Cholesterinspiegels eingesetzt werden, die Retikulation hemmen und damit zur Kontrolle der Virusinfektionen eingesetzt werden könnten.
»Der Tumor beeinflusst das Gehirn, und das Gehirn beeinflusst den Tumor. Das ist ein Grad an Komplexität, der fast erschreckend ist«Frank Winkler
HIV ist nicht der einzige Übeltäter, der die Fähigkeit dendritischer Zellen zur Bildung von TNTs zum eigenen Vorteil missbraucht. Prionen (die zum Beispiel beim Verzehr von Fleisch eines Rindes mit Rinderwahnsinn erworben werden) sowie andere inkorrekt gefaltete Proteine übernehmen die Zellkommunikationsnetze ebenfalls, erklärt die Pasteur-Forscherin Chiara Zurzolo. Falsch gefaltete Proteine, die im Gehirn verklumpen oder Fehler bei der Proteinfaltung begünstigen, gelten als eine der Hauptursachen für neurodegenerative Erkrankungen. Beispiele für solche fehlgefalteten Proteine sind Tau, Alpha-Synuclein und Huntingtin, die für die Entstehung von Alzheimer, Parkinson und Huntington verantwortlich sind. Bis vor einigen Jahren war unklar, wie sich diese schädlichen Proteine von Zelle zu Zelle gelangen: Schließlich besitzen sie im Gegensatz zu Viren oder Bakterien keine eigenen Mittel, um sich auszubreiten.
Dass dendritische Zellen Prionen auf die Neurone übertragen können, zeigte Zurzolos Studie aus dem Jahr 2009, die zum Fundament des heutigen Modells der Aufnahme und Verbreitung von Prionen über TNTs wurde. Dieser Vorstellung zufolge nehmen dendritische Zellen die Proteine im Darm auf, den sie ständig nach Infektionen durchforsten. Auf ihrem Weg durch den Körper streuen sie die Prionen dann mittel TNTs in die Milz, die Lymphknoten und ins periphere Nervensystem. Einmal im Nervensystem angelangt, können die Prionen sich dann über TNTs problemlos von einem Neuron zum nächsten hangeln und so das gesamte Gehirn befallen. Die Entdeckung, dass sich falsch gefaltete Proteine von Zelle zu Zelle bewegen können, »war wirklich ein Durchbruch«, sagt Zurzolo.
Im Laufe des letzten Jahrzehnts konnte sie zudem nachweisen, dass sich auch die falsch gefalteten Proteine, die an der Alzheimer- und Parkinson-Krankheit beteiligt sind, über TNTs im Gehirn ausbreiten. »Wir denken, dass wir einige dieser Krankheiten heilen können, wenn wir die TNTs zwischen den Zellen zerstören und so die Ausbreitung der Proteine stoppen«, sagt sie. Allerdings müsste man dabei vorsichtig vorgehen, denn Gliazellen, die Stützzellen des Nervensystems, kommunizieren ebenfalls über TNTs. Sie unspezifisch zu zerstören, könnte die normale Physiologie des Gehirns stören.
Angesichts der Rolle, die TNTs bei der Ausbreitung von Krebs, HIV und neurodegenerativen Erkrankungen spielen, wundert es nicht, dass Forscher und Pharmaunternehmen nach Wegen suchen, die Bildung der Nanoröhrchen zu unterdrücken. Was aber, wenn man die Brücken für therapeutische Zwecke nutzen könnte?
Ungeahnte Anwendungen in der regenerativen Medizin
Anne-Marie Rodriguez, Forscherin am Institut Mondor de Recherche Biomédicale in Paris, hat entdeckt, dass TNTs Herzzellen helfen, sich nach einem Infarkt zu erholen. Die Herzattacke sorgt für eine Sauerstoffunterversorgung der Herzmuskelzellen und in der Folge dafür, dass die Mitochondrien geschädigter Zellen so genannte reaktive Sauerstoffspezies freisetzen. Diese aggressiven Moleküle rufen benachbarte mesenchymale Stammzellen auf den Plan, die ihrerseits beginnen, vermehrt Mitochondrien zu produzieren, die sie den kränkelnden Herzzellen dann über TNTs verabreichen. Die Stammzellen seien also zugleich Sensoren von und Rettungskräfte für verletztes Gewebes, sagt Rodriguez.
Dass TNTs bei der Behandlung einer Krankheit längst eine zentrale Rolle spielen, hat Stephanie Cherqui zufällig herausgefunden. Die Regenerativmedizinerin und Stammzellforscherin an der University of California in San Diego erforscht unter anderem die Zystinose, eine seltene Krankheit, die durch ein einzelnes defektes Gen verursacht wird. Der Defekt führt dazu, dass sich die Aminosäure Cystin im gesamten Körper in toxischen Mengen anreichert, was insbesondere die Nieren schädigt. Cherquis Therapiekonzept, das sie an Mäusen entwickelte, besteht darin, hämatopoetische (Blut bildende) Stammzellen aus den Knochen zu entnehmen und in ihnen eine funktionsfähige Kopie des defekten Gens einzufügen. Dann befreit sie das Knochenmark mit einer Chemotherapie von seinen originären Stammzellen und ersetzt sie mit den manipulierten. So weit die Theorie: »Meine Kollegen bezweifelten, dass Knochenmarksstammzellen bei Verletzungen des Nierengewebes irgendetwas ausrichten würden«, sagt Cherqui. »Ich war sehr überrascht, als ich sah, dass die Blutstammzellen den Gewebsschaden in den Nieren von Mäusen mit Zystinose dauerhaft beheben konnten.«
Wie aber gelingt es den manipulierten Stammzellen aus dem Knochenmark, solche Gewebeschäden zu reparieren? Zunächst differenzieren sie sich zu so genannten Makrophagen. Diese Immunzellen wandern dann in das geschädigte Nierengewebe ein, docken dort über TNTs an die erkrankten Nierenzellen an und schicken ihnen frische Lysosomen. Über die gleichen Kanäle schiffen die erkrankten Zellen ihre defekten Lysosomen an die Makrophagen zurück.
»Ich glaube fest daran, dass diese zytoplasmatischen Fortsätze der Schlüssel zu Gesundheit und Krankheit des Menschen sind«Stephanie Cherqui
»Wir haben hier einen ganz neuen Wirkmechanismus demonstriert«, sagt Cherqui, »und wir glauben, dass wir diese Behandlungsmethode auf mehr Krankheiten als gedacht anwenden können.« Einen ähnlichen Ansatz hat sie bereits bei der Behandlung einer mitochondrialen Erkrankung namens Friedreich-Ataxie getestet. In ersten Zellkulturstudien konnte sie zeigen, dass die Makrophagen in diesem Fall gesunde Mitochondrien über TNTs zur Verfügung stellen. Derzeit untersucht Cherqui diesen Therapieansatz unter anderem in Hirn, Herz und Muskeln.
Eine elementare Funktion
Bei all diesen Fortschritten erscheint Skepsis angebracht, bis man die grundlegende biologische Funktionsweise der TNTs besser verstanden hat. Dazu braucht es, meinen auch TNT-Forschergruppen einhellig, vor allem neue Biomarker, mit denen man TNTs besser kennzeichnen kann. Darüber hinaus müssen die zellulären Signalwege, die die Bildung der winzigen Röhrchen auslösen, besser verstanden werden. »Wir brauchen gute Zellbiologen, die alle Subtypen untersuchen«, sagt etwa Winkler. »Im Moment haben wir keine Ahnung, ob ihre molekulare Maschinerie wirklich überall die gleiche ist.« Es gebe noch viel zu lernen.
Dem stimmt auch Chiara Zurzolo zu. Trotzdem ist sie schon jetzt davon überzeugt, dass TNTs eine bedeutende Rolle spielen werden: »TNTs übernehmen eine Vielzahl von Aufgaben und spielen daher sicher eine Rolle bei vielen Krankheiten«, sagt sie: »Am Ende handelt es sich eben um Zell-zu-Zell-Kommunikation - eine der fundamentalsten Funktionen einer Zelle.«
Von »Spektrum der Wissenschaft« übersetzte und redigierte Fassung des Artikels »Cells Talk and Help One Another via Tiny Tube Networks« aus »Quanta Magazine«, einem inhaltlich unabhängigen Magazin der Simons Foundation, die sich die Verbreitung von Forschungsergebnissen aus Mathematik und den Naturwissenschaften zum Ziel gesetzt hat.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.