Neurodegeneration: Gezielte Blockadebrecher
Alzheimerforscher melden Erfolge an zwei Fronten: Klarer wird, was in den Neuronen schiefläuft – und wie man ohne Kollateralschäden Schlimmeres verhindern könnte.
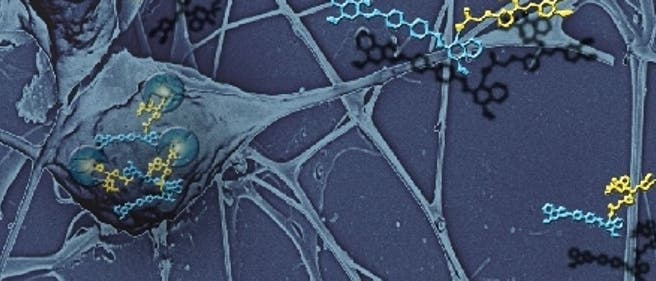
© Isabella A. Graef, Graef Lab, Stanford University (Ausschnitt)
Im Gehirn von Alzheimerdemenz-Patienten fallen besonders zwei krankhaft veränderte Proteinansammlungen ins Auge: Man findet zum einen zwischen den Hirnneuronen Plaques aus verklumpten A-Beta-Peptiden, zum anderen lagern sich in den Zellen Faserbündel aus Tau-Protein ab.
Noch immer ist allerdings nicht klar, wie Plaques und Krankheitssymtome zusammenhängen. Dabei legten verschiedene Alzheimerforscher schon ein Sammelsurium recht unterschiedlicher Erklärungen vor – so sollen die plaquebildenden A-Beta-Proteine die Blutgerinnungsprozesse im Gehirn und damit die Versorgung stören oder die Signalübertragung von Nervenzellen im Hippocampus verändern, weil sie bestimmte Ionenkanäle beeinträchtigen.
Bei allen Wissenslücken über das "Wie" der schädlichen A-Beta-Wirkung: Mit Hochdruck arbeiten Alzheimermediziner trotzdem daran, das Entstehen dieser Plaques zu verhindern, um, so die Hoffnung, damit auch irgendwie die Symptome verschwinden zu lassen. Schon früh haben sie sich dabei auf die Enzyme eingeschossen, durch die A-Beta entsteht, die Sekretasen. Sie zerlegen das lange Beta-Amyloid-Vorläuferprotein (beta-amyloid precursor protein, APP) in kleinere Bruchstücke, von denen eines die krankhaft verklumpende A-Beta-Peptid-Variante ist. Ohne Sekretasen, so die Idee, auch kein A-Beta. Und keine Alzheimerdemenz?
Die ersten Attacken auf die Sekretasen führten die Mediziner eher mit dem Holzhammer als dem Florett: Sie schalteten die Enzyme möglichst vollständig ab – was Zellen und Versuchstieren aber nicht gut bekommt, weil die Enzyme nicht nur A-Beta aus APP herausschneiden, sondern auch eine Reihe anderer wichtiger Proteine herstellen. So kann man nicht einmal die bei Alzheimer hauptsächlich beteiligte Gamma-Sekretase – ein Enzymkomplex, der das Entstehen der besonders verklumpungsgefährdeten, etwas längeren A42-Beta-Petidvarianten aus einem vorgetrimmten AP-Protein fördert – gefahrlos abknipsen: Die Gamma-Sekretase bildet nämlich ganz genauso auch den zentralen lebenswichtigen Entwicklungsregulator Notch.
Steven Wagner von der University of California in San Diego und seine Kollegen hatten aber schon vor einiger Zeit begonnen, nach möglichst gezielten Methoden zu suchen, mit denen nur bestimmte Funktionen der Gamma-Sekretase ausgeschaltet werden kann, ohne dabei andere zu beeinträchtigen. Nun selektierten sie aus 1200 neuartigen Synthesesubstanzen tatsächlich einen Wirkstoff heraus, der vielleicht einmal nebenwirkungsarm gegen Alzheimerdemenz wirken könnte und sich auch als oral verabreichtes Medikament eignen würde [1].
Mit "Compound 4" stellen sie einen Hemmstoff vor, der die Gamma-Sekretase wie gewünscht zum Teil ausschaltet. Der Enzymhemmer – ein Diarylaminothiazol, also ein über eine Aminogruppe verbundenes Mehrfachringsystem – stört offenbar effektiv genau die aktiven Zentren der multifunktionalen Gamma-Sekretase, die das Zerschneiden des Vorläuferproteins in A-Beta besorgen: Mäuse, die den Wirkstoff mit dem Futter verabreicht bekamen, hatten deutlich niedrigere Konzentrationen von A-Beta im Blut und Gehirn. Andere Funktionen, etwa die Produktion von Notch, waren nicht beeinträchtigt.
Nun muss aber noch geklärt werden, ob die Blockade der A-Beta-Peptid-Freisetzung tatsächlich auch demenzkranken Menschen nützt. Das ist schwer vorherzusagen, denn immer noch ist zu wenig darüber bekannt, wie die Proteinplaques und die Krankheit überhaupt zusammenhängen. Die Ablagerungen sammeln sich – in deutlich geringerer Menge – schließlich auch im Lauf des normalen Alterungsprozesses oder bei anderen Erkrankungen des Gehirns an. Welche Ursachen ihrer ausufernden Vermehrung bei Demenzkranken zu Grunde liegen und ob diese Ursachen durch den Abbau der Proteinplaques verhindert werden, ist unklar.
Viele Forscher denken, dass die verklumpungsgefährdeten A-Beta-Peptide auf irgendeine Weise den Transport anderer Eiweiße durch die Axone, also die langen Zellausläufer der Neurone, behindern – was, ebenfalls zumindest bei Alzheimermodellmäusen nachgewiesen, zu krankhaft veränderter neuronaler Aktivität und damit einhergehenden Verhaltensänderungen führt.
Eine ähnliche Rolle scheint im Übrigen auch das zweite auffällige Protein, das in den Zellen abgelagerte Tau, zu spielen, berichten nun Keith Vossel von der University of California in San Francisco und seine Kollegen. Wird die Produktion von Tau in Alzheimermodellmäusen verhindert, so bessern sich ihre Demenzsymptome wohl deshalb, weil die Mikrotubuli-Autobahnen in den lang gestreckten Neuronen nicht länger blockiert werden. Massen von A-Beta und Tau gemeinsam bremsen dagegen den Transport von anderen Proteinen oder Mitochondrien durch die Zelle, zeigen die Forscher [2]. Die Krankheit nicht im Detail zu verstehen, muss nicht bedeuten, sie nicht behandeln zu können, meinen die beiden Forschergruppen aus Kalifornien.
Noch immer ist allerdings nicht klar, wie Plaques und Krankheitssymtome zusammenhängen. Dabei legten verschiedene Alzheimerforscher schon ein Sammelsurium recht unterschiedlicher Erklärungen vor – so sollen die plaquebildenden A-Beta-Proteine die Blutgerinnungsprozesse im Gehirn und damit die Versorgung stören oder die Signalübertragung von Nervenzellen im Hippocampus verändern, weil sie bestimmte Ionenkanäle beeinträchtigen.
Bei allen Wissenslücken über das "Wie" der schädlichen A-Beta-Wirkung: Mit Hochdruck arbeiten Alzheimermediziner trotzdem daran, das Entstehen dieser Plaques zu verhindern, um, so die Hoffnung, damit auch irgendwie die Symptome verschwinden zu lassen. Schon früh haben sie sich dabei auf die Enzyme eingeschossen, durch die A-Beta entsteht, die Sekretasen. Sie zerlegen das lange Beta-Amyloid-Vorläuferprotein (beta-amyloid precursor protein, APP) in kleinere Bruchstücke, von denen eines die krankhaft verklumpende A-Beta-Peptid-Variante ist. Ohne Sekretasen, so die Idee, auch kein A-Beta. Und keine Alzheimerdemenz?
Die ersten Attacken auf die Sekretasen führten die Mediziner eher mit dem Holzhammer als dem Florett: Sie schalteten die Enzyme möglichst vollständig ab – was Zellen und Versuchstieren aber nicht gut bekommt, weil die Enzyme nicht nur A-Beta aus APP herausschneiden, sondern auch eine Reihe anderer wichtiger Proteine herstellen. So kann man nicht einmal die bei Alzheimer hauptsächlich beteiligte Gamma-Sekretase – ein Enzymkomplex, der das Entstehen der besonders verklumpungsgefährdeten, etwas längeren A42-Beta-Petidvarianten aus einem vorgetrimmten AP-Protein fördert – gefahrlos abknipsen: Die Gamma-Sekretase bildet nämlich ganz genauso auch den zentralen lebenswichtigen Entwicklungsregulator Notch.
Steven Wagner von der University of California in San Diego und seine Kollegen hatten aber schon vor einiger Zeit begonnen, nach möglichst gezielten Methoden zu suchen, mit denen nur bestimmte Funktionen der Gamma-Sekretase ausgeschaltet werden kann, ohne dabei andere zu beeinträchtigen. Nun selektierten sie aus 1200 neuartigen Synthesesubstanzen tatsächlich einen Wirkstoff heraus, der vielleicht einmal nebenwirkungsarm gegen Alzheimerdemenz wirken könnte und sich auch als oral verabreichtes Medikament eignen würde [1].
Mit "Compound 4" stellen sie einen Hemmstoff vor, der die Gamma-Sekretase wie gewünscht zum Teil ausschaltet. Der Enzymhemmer – ein Diarylaminothiazol, also ein über eine Aminogruppe verbundenes Mehrfachringsystem – stört offenbar effektiv genau die aktiven Zentren der multifunktionalen Gamma-Sekretase, die das Zerschneiden des Vorläuferproteins in A-Beta besorgen: Mäuse, die den Wirkstoff mit dem Futter verabreicht bekamen, hatten deutlich niedrigere Konzentrationen von A-Beta im Blut und Gehirn. Andere Funktionen, etwa die Produktion von Notch, waren nicht beeinträchtigt.
Nun muss aber noch geklärt werden, ob die Blockade der A-Beta-Peptid-Freisetzung tatsächlich auch demenzkranken Menschen nützt. Das ist schwer vorherzusagen, denn immer noch ist zu wenig darüber bekannt, wie die Proteinplaques und die Krankheit überhaupt zusammenhängen. Die Ablagerungen sammeln sich – in deutlich geringerer Menge – schließlich auch im Lauf des normalen Alterungsprozesses oder bei anderen Erkrankungen des Gehirns an. Welche Ursachen ihrer ausufernden Vermehrung bei Demenzkranken zu Grunde liegen und ob diese Ursachen durch den Abbau der Proteinplaques verhindert werden, ist unklar.
Viele Forscher denken, dass die verklumpungsgefährdeten A-Beta-Peptide auf irgendeine Weise den Transport anderer Eiweiße durch die Axone, also die langen Zellausläufer der Neurone, behindern – was, ebenfalls zumindest bei Alzheimermodellmäusen nachgewiesen, zu krankhaft veränderter neuronaler Aktivität und damit einhergehenden Verhaltensänderungen führt.
Eine ähnliche Rolle scheint im Übrigen auch das zweite auffällige Protein, das in den Zellen abgelagerte Tau, zu spielen, berichten nun Keith Vossel von der University of California in San Francisco und seine Kollegen. Wird die Produktion von Tau in Alzheimermodellmäusen verhindert, so bessern sich ihre Demenzsymptome wohl deshalb, weil die Mikrotubuli-Autobahnen in den lang gestreckten Neuronen nicht länger blockiert werden. Massen von A-Beta und Tau gemeinsam bremsen dagegen den Transport von anderen Proteinen oder Mitochondrien durch die Zelle, zeigen die Forscher [2]. Die Krankheit nicht im Detail zu verstehen, muss nicht bedeuten, sie nicht behandeln zu können, meinen die beiden Forschergruppen aus Kalifornien.

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.