News: Milde Lösung
Ammoniak gehört zu den wichtigsten Produkten der chemischen Industrie und wird seit über 70 Jahren nach dem bewährten Haber-Bosch-Verfahren in Millionen Tonnen jährlich hergestellt. Doch die Methode hat entscheidende Haken. Gibt es bald eine Alternative?
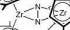
© (Ausschnitt)
Molekularer Stickstoff, der Hauptbestandteil unserer Luft, ist ein ausgesprochen träger Geselle: Unpolar, ein festes Pärchen dank drei Bindungen und wenig Bereitschaft, sich ionisieren zu lassen, beteiligt er sich nur ungern an irgendwelchen Reaktionen. Erst mit viel Druck und äußerst warmem Zureden gelingt es, das Gas mithilfe eines Eisen- oder neuerdings Ruthenium-Katalysators zu engerer Bekanntschaft mit Wasserstoff zu bewegen. Das begehrte Endprodukt: Ammoniak, ein Grundbaustein für viele Produkte der chemischen Industrie, vom Dünger über Farbstoffe bis hin zu Pharmazeutika.
Jenes Verfahren, benannt nach seinen Entwicklern Fritz Haber, der die Grundlagen entdeckte, und Carl Bosch, der die industrielle Anwendung ausarbeitete – wofür sie jeweils mit einem Nobelpreis geehrt wurden –, liefert nun seit über 70 Jahren inzwischen über 100 Millionen Tonnen Ammoniak jährlich. Und obwohl die Methode bewährt ist, steht sie immer wieder auf dem Prüfstand: Lässt sich nicht ein neuer Weg finden, der mit weniger Druck und geringeren Temperaturen arbeitet? Und der – auch das wäre von Interesse – das Ganze einfach in flüssiger Umgebung geschehen lässt?
Bisher suchten die Wissenschaftler vergeblich. Jaime Pool, Emil Lobkovsky und Paul Chirik aber konnten nun wenigstens erste Schritte in Richtung milderer Lösung präsentieren: Die Forscher von der Cornell University untersuchten bestimmte Zirkonium-Komplexverbindungen, bei denen – zwei Regenschirmen gleich – an dem zentralen Zirkonium-Atom zwei aromatische Kohlenstoffringe hängen. An diesen so genannten Cyclopentadienylen waren die Wasserstoffatome, die normalerweise den Ring schmücken, durch weitere Methylgruppen ersetzt worden. Die Wissenschaftler wollten nun klären, inwieweit sich Veränderungen im Bereich der organischen Anhängsel auf das Kontaktverhalten von kleinen Molekülen wie N2 an das Metall auswirkt.
Und sie stolperten über Erstaunliches: Als sie an den Ringen eine Methylgruppe wieder durch Wasserstoff ersetzten, entwickelte elementarer Stickstoff plötzlich verbindliches Interesse an seinen komplexen Nachbarn – und knüpfte feste Bande zu zwei Exemplaren links und rechts. Nur noch ein zartes Elektronenpaar statt der vorherigen drei hielt nun noch die beiden Stickstoffatome in der überbrückenden Mitte zusammen, während sie den beiden Metallpartnern jeweils ein bindungsfreudiges Ärmchen entgegen streckten. Ein farbenfrohes Ergebnis – der grüne Feststoff zeigt sich in Lösung purpurrot – ganz ohne Druck und Hitze.
Im nächsten Schritt leiteten die Chemiker bei Zimmertemperatur Wasserstoff in eine Pentanlösung ihrer neuen Errungenschaft ein und erhielten dadurch sofort einen weißen Niederschlag. Dieser entpuppte sich als die vorherige Verbindung, nun allerdings mit zusätzlichen Beteiligten: Die beiden Stickstoffatome hatten sich noch jeweils ein Wasserstoffatom geschnappt und dafür offenbar sogar an das sonst meist ungenutzte letzte freie Elektronenpaar mobilisiert. Das allerdings ist ausgesprochen ungewöhnlich, denn normalerweise behagt Stickstoff in Metall-Komplexverbindungen der Wasserstoffbesucher gar nicht, und er sucht elementar das Weite, während H2 den freigewordenen Platz einnimmt.
Mit kochendem Heptan setzten die Wissenschaftler nun dem Stickstoff weiter zu, bis er gar das letzte verbindende Händchen zwischen sich los ließ. Später zeigte sich, dass schon Temperaturen von eher lauschigen 45 Grad Celsius den endgültigen Bruch bewirkten – allerdings nur dann, wenn der ebenfalls freigesetzte Wasserstoff ständig aus dem System entfernt wurde. Wie überall ist auch hier alles eine Frage des richtigen Gleichgewichts.
Viel interessanter aber war die harsche Behandlung dieses gesamten Konstruktes mit Unmengen wasserfreier Salzsäure, durch die der Komplex zu seiner ursprünglichen kleineren Zusammensetzung zurückfand – unter Ausschluss von zwei Äquivalenten NH4Cl – dem sehr begehrten Ammoniumchlorid, einem Ammoniaksalz.
Das allerdings ging sogar noch einfacher: Indem die Forscher schlicht das Zwischenprodukt mit den gerade frisch eingeheimsten Wasserstoffbegleitern in weiterer H2-Umgebung auf 85 Grad Celsius erhitzten. Keine Säure, kein Entzug war nötig, um nun Stickstoff und Wasserstoff als Ammoniak in die Welt zu entlassen, während das Zirkonium sich wieder ausschließlich seinen organischen Anhängseln widmen konnte, wie es sich für einen Katalysator auch gehört.
Alles in allem eine verblüffend einfach anmutende Prozedur. Könnte sie dem Haber-Bosch-Verfahren Konkurrenz machen, nachdem sie insbesondere die Hoffnung auf simplere Reaktionsbedingungen erfüllt? Heute oder morgen wohl noch nicht, denn die Ausbeute ist mit 10 bis 15 Prozent bisher sehr gering. Aber vielleicht eröffnen sich nun ja noch ganz neue Lösungswege.
Jenes Verfahren, benannt nach seinen Entwicklern Fritz Haber, der die Grundlagen entdeckte, und Carl Bosch, der die industrielle Anwendung ausarbeitete – wofür sie jeweils mit einem Nobelpreis geehrt wurden –, liefert nun seit über 70 Jahren inzwischen über 100 Millionen Tonnen Ammoniak jährlich. Und obwohl die Methode bewährt ist, steht sie immer wieder auf dem Prüfstand: Lässt sich nicht ein neuer Weg finden, der mit weniger Druck und geringeren Temperaturen arbeitet? Und der – auch das wäre von Interesse – das Ganze einfach in flüssiger Umgebung geschehen lässt?
Bisher suchten die Wissenschaftler vergeblich. Jaime Pool, Emil Lobkovsky und Paul Chirik aber konnten nun wenigstens erste Schritte in Richtung milderer Lösung präsentieren: Die Forscher von der Cornell University untersuchten bestimmte Zirkonium-Komplexverbindungen, bei denen – zwei Regenschirmen gleich – an dem zentralen Zirkonium-Atom zwei aromatische Kohlenstoffringe hängen. An diesen so genannten Cyclopentadienylen waren die Wasserstoffatome, die normalerweise den Ring schmücken, durch weitere Methylgruppen ersetzt worden. Die Wissenschaftler wollten nun klären, inwieweit sich Veränderungen im Bereich der organischen Anhängsel auf das Kontaktverhalten von kleinen Molekülen wie N2 an das Metall auswirkt.
Und sie stolperten über Erstaunliches: Als sie an den Ringen eine Methylgruppe wieder durch Wasserstoff ersetzten, entwickelte elementarer Stickstoff plötzlich verbindliches Interesse an seinen komplexen Nachbarn – und knüpfte feste Bande zu zwei Exemplaren links und rechts. Nur noch ein zartes Elektronenpaar statt der vorherigen drei hielt nun noch die beiden Stickstoffatome in der überbrückenden Mitte zusammen, während sie den beiden Metallpartnern jeweils ein bindungsfreudiges Ärmchen entgegen streckten. Ein farbenfrohes Ergebnis – der grüne Feststoff zeigt sich in Lösung purpurrot – ganz ohne Druck und Hitze.
Im nächsten Schritt leiteten die Chemiker bei Zimmertemperatur Wasserstoff in eine Pentanlösung ihrer neuen Errungenschaft ein und erhielten dadurch sofort einen weißen Niederschlag. Dieser entpuppte sich als die vorherige Verbindung, nun allerdings mit zusätzlichen Beteiligten: Die beiden Stickstoffatome hatten sich noch jeweils ein Wasserstoffatom geschnappt und dafür offenbar sogar an das sonst meist ungenutzte letzte freie Elektronenpaar mobilisiert. Das allerdings ist ausgesprochen ungewöhnlich, denn normalerweise behagt Stickstoff in Metall-Komplexverbindungen der Wasserstoffbesucher gar nicht, und er sucht elementar das Weite, während H2 den freigewordenen Platz einnimmt.
Mit kochendem Heptan setzten die Wissenschaftler nun dem Stickstoff weiter zu, bis er gar das letzte verbindende Händchen zwischen sich los ließ. Später zeigte sich, dass schon Temperaturen von eher lauschigen 45 Grad Celsius den endgültigen Bruch bewirkten – allerdings nur dann, wenn der ebenfalls freigesetzte Wasserstoff ständig aus dem System entfernt wurde. Wie überall ist auch hier alles eine Frage des richtigen Gleichgewichts.
Viel interessanter aber war die harsche Behandlung dieses gesamten Konstruktes mit Unmengen wasserfreier Salzsäure, durch die der Komplex zu seiner ursprünglichen kleineren Zusammensetzung zurückfand – unter Ausschluss von zwei Äquivalenten NH4Cl – dem sehr begehrten Ammoniumchlorid, einem Ammoniaksalz.
Das allerdings ging sogar noch einfacher: Indem die Forscher schlicht das Zwischenprodukt mit den gerade frisch eingeheimsten Wasserstoffbegleitern in weiterer H2-Umgebung auf 85 Grad Celsius erhitzten. Keine Säure, kein Entzug war nötig, um nun Stickstoff und Wasserstoff als Ammoniak in die Welt zu entlassen, während das Zirkonium sich wieder ausschließlich seinen organischen Anhängseln widmen konnte, wie es sich für einen Katalysator auch gehört.
Alles in allem eine verblüffend einfach anmutende Prozedur. Könnte sie dem Haber-Bosch-Verfahren Konkurrenz machen, nachdem sie insbesondere die Hoffnung auf simplere Reaktionsbedingungen erfüllt? Heute oder morgen wohl noch nicht, denn die Ausbeute ist mit 10 bis 15 Prozent bisher sehr gering. Aber vielleicht eröffnen sich nun ja noch ganz neue Lösungswege.

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.