Biotechnologie: Modelle menschlicher Embryonen werden immer realistischer
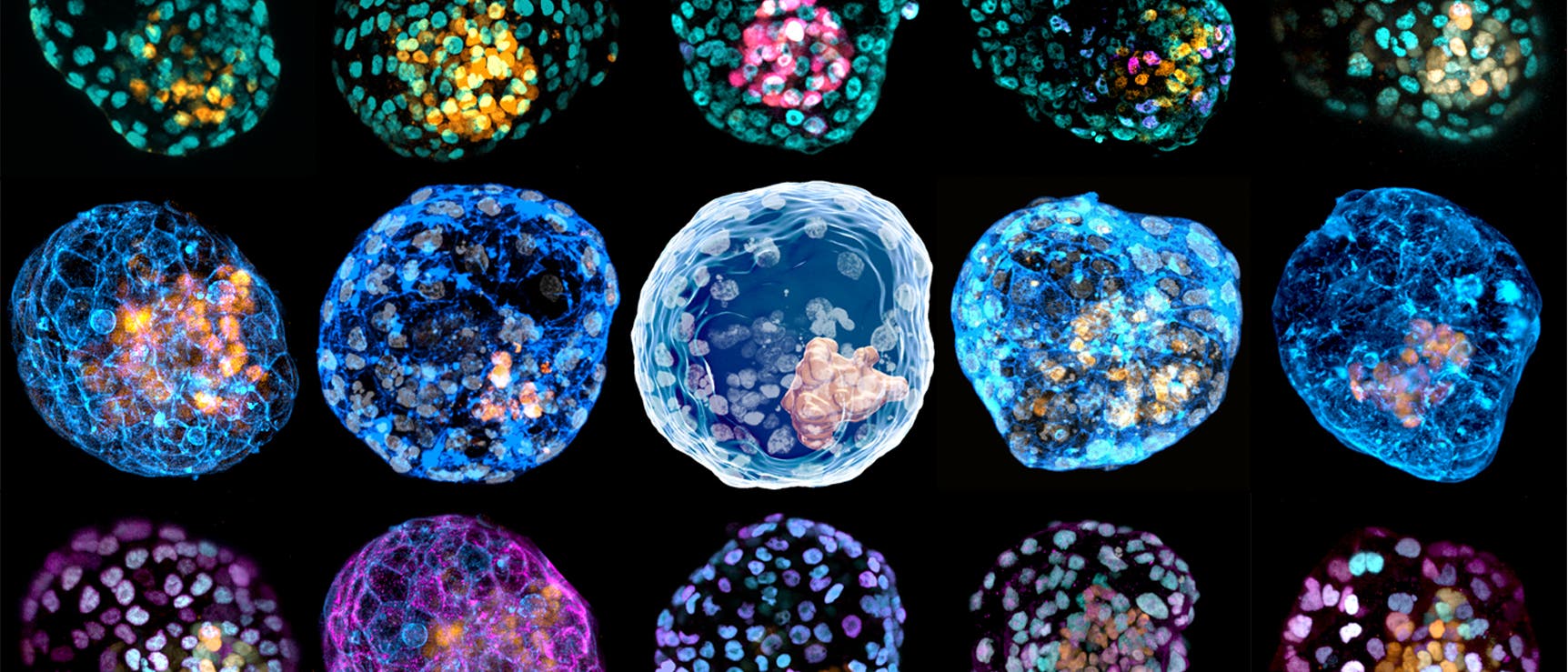
Unter dem Mikroskop waren winzige Kugeln zu erkennen, jede weniger als einen Millimeter im Durchmesser. Sie sahen genauso aus wie menschliche Embryonen: eine dünne Hülle aus Zellen, die einen Hohlraum sowie einen dunkel erscheinenden Zellhaufen umgibt.
Doch der Schein trog. Es handelte sich um Modelle menschlicher Embryonen, die der Stammzellbiologe Jun Wu am University of Texas Southwestern Medical Center in Dallas und sein Team gezüchtet hatten, und sie waren alles andere als perfekte Nachbildungen ihrer natürlichen Vorbilder. In den nachgemachten Embryonen fehlten einerseits ganze Gruppen von Zellen; andererseits enthielten sie Strukturen in ihrem Inneren, die dort nicht hingehörten. Es war klar, dass sie sich nicht richtig entwickeln und irgendwann zu Grunde gehen würden.
Wären Embryonenmodelle Häuser, dann hätten sie eine halbwegs echt anmutende Fassade, hinter der sich aber krumme Böden und schiefe Möbel befänden und in denen ganze Etagen fehlen würden. Nichtsdestoweniger konkurrieren dutzende Forschungsgruppen darum, die beste zelluläre Nachbildung eines menschlichen Embryos zu züchten. Jedes Team legt sein Augenmerk dabei auf einen anderen Aspekt der Embryonalentwicklung und versucht, ihn detailliert nachzuvollziehen – in der Hoffnung, neue empirische Erkenntnisse über die ersten Wochen nach der Befruchtung der Eizelle zu gewinnen.
Denn jener Abschnitt der Individualentwicklung »birgt noch zahlreiche Geheimnisse«, wie Nicolas Rivron betont, Entwicklungsbiologe am Institut für Molekulare Biotechnologie der Österreichischen Akademie der Wissenschaften in Wien. Im Mutterleib seien die Embryonen in diesem Stadium noch zu klein, um sie per Ultraschall zu beobachten. Und im Labor stehen hohe technische, ethische und rechtliche Hürden dem Anliegen entgegen, echte Embryonen außerhalb des mütterlichen Körpers über den 14. Tag nach der Befruchtung hinaus zu untersuchen.
Embryonenforschung könnte vielen Menschen helfen
Dabei gibt es zahlreiche gute Gründe, solche Forschungsarbeiten zu betreiben. Empirische Erkenntnisse aus Studien an Embryonenmodellen könnten helfen zu verstehen, warum etwa jeder dritte natürliche Embryo die ersten Schwangerschaftswochen nicht überlebt. Dies könnte dazu beitragen, ungewollte Unfruchtbarkeit zu überwinden, die Erfolgsrate künstlicher Befruchtungen zu steigern und Krankheiten zu bekämpfen, die in frühen Phasen der Schwangerschaft auftreten. Embryonenmodelle lassen sich zudem dazu nutzen, die Anwendungssicherheit von Schwangerschaftsmedikamenten zu prüfen.
Da diese Modelle jedoch immer komplexer werden und zunehmend Eigenschaften zeigen, die eine hohe symbolische Bedeutung haben – etwa erste Anzeichen einer Herztätigkeit –, werfen sie brisante ethische Fragen auf. Ethikkommissionen, Regulierungsbehörden und Juristen bemühen sich, mit dem Tempo der Forschung Schritt zu halten. Im Februar 2024 veranstalteten Fachleute die weltweit erste wissenschaftliche Tagung, die sich ausschließlich mit Embryonenmodellen befasste. Wissenschaftlerinnen und Wissenschaftler haben bereits mehrere Spin-off-Unternehmen gegründet, die mit Hilfe solcher Modelle Arzneistoffe entwickeln, Medikamente testen und Methoden der künstlichen Befruchtung verbessern. Die Forschung an Embryomodellen gehöre derzeit zu den bedeutsamsten Themen der Biomedizin, sagt Insoo Hyun, der als Bioethik-Berater für das Massachusetts Institute of Technology und die Harvard University (beide in Cambridge, Massachusetts) tätig ist.
Das Aufeinandertreffen von Ei- und Samenzelle löst einen Prozess schneller und präzise choreografierter Zellteilungen aus, dem komplexe Differenzierungsprozesse folgen. Binnen der ersten Woche nach der Befruchtung entstehen etwa 200 Zellen, die gemeinsam eine Blastozyste bilden: eine Hohlkugel mit innen liegendem Zellhaufen. Sie besteht aus drei verschiedenen Gruppen von Zellen, aus denen später der Embryo, der Dottersack und die Plazenta hervorgehen.
Die Blastozyste pflanzt sich in die Schleimhaut der Gebärmutter ein. Etwa zwei Wochen nach der Befruchtung beginnt der Embryo einen Prozess namens Gastrulation zu durchlaufen. Dabei stülpt sich die Blastozyste ein und es entstehen drei Keimblätter mit den Bezeichnungen Entoderm, Mesoderm und Ektoderm. Die Keimblätter differenzieren sich im Zuge der so genannten Organogenese weiter zu Lungen, Baucheingeweiden, Muskeln und all den anderen Organen des entstehenden Menschen.
»Ein Embryo durchläuft dramatische Veränderungen«Naomi Moris, Entwicklungsbiologin
»Der Embryo befindet sich in ständigem Wandel«, schildert Naomi Moris, Entwicklungsbiologin am Francis Crick Institute in London, »er durchläuft dramatische Veränderungen.« Forscherinnen und Forscher versuchen schon seit Langem, diesen Prozess außerhalb des mütterlichen Organismus in einer Petrischale nachzustellen – zumindest in Teilen. Im Zuge solcher Studien, oft mit Zellen der Maus oder des Menschen durchgeführt, ist es den Fachleuten gelungen, wichtige Einblicke in die Embryonalentwicklung zu gewinnen.
Im Jahr 2014 brachte ein Forschungsteam menschliche embryonale Stammzellen dazu, drei separate Ringstrukturen zu bilden, die Vorläufern eines Embryos und einer Plazenta entsprachen. Embryonenmodelle, die in den darauf folgenden Jahren entwickelt wurden, prägten Amnionhöhlen (Vorstufen der späteren Leibeshöhlen) sowie Dottersäcke aus. 2020 stellte eine Forschungsgruppe mit embryonalen Stammzellen einen Prozess der Gastrulation nach, bei dem sich der Embryo in eine röhrenähnliche Struktur umwandelt. An heutigen Maßstäben gemessen, würden viele Fachleute diese experimentellen Gebilde jedoch nicht als Modelle eines vollständigen Embryos ansehen, sagt Wu.
Ein ganzheitliches Modell
Ein wichtiger Meilenstein auf dem Weg zum umfassenden Labormodell wurde im Jahr 2021 erreicht. Da stellten Jun Wus Forschungsteam sowie eine weitere Arbeitsgruppe zelluläre Embryonenmodelle vor, die der menschlichen Blastozyste ähneln (siehe »Embryonale Entwicklungsstadien«) – jenem Entwicklungsabschnitt, in dem Embryonen während einer künstlichen Befruchtung typischerweise in die Gebärmutter übertragen werden.
Diese als »Blastoide« bezeichneten Modelle enthalten sowohl Zellen, aus denen der Embryo selbst hervorgeht, als auch solche, die ihn unterstützende Strukturen hervorbringen – so genannte extraembryonale Zellen. Blastoide sind damit die ersten vollständigen oder »ganzheitlichen« Modelle menschlicher Embryonen. »Sie bilden die Embryonalentwicklung nicht perfekt ab, aber sie tun es ziemlich gut«, sagt Marta Shahbazi, Stammzell- und Entwicklungsbiologin am MRC Laboratory of Molecular Biology in Cambridge (Vereinigtes Königreich).
Einige Forschungsgruppen haben versucht, noch frühere embryonale Entwicklungsstadien (also solche vor der Blastozyste) zu rekapitulieren, indem sie Stammzellen verwendeten, die sich in jeden Zelltyp umwandeln können, der für die Embryogenese erforderlich ist (die meisten derzeit gebräuchlichen Modelle setzen auf Zellen mit etwas begrenzteren Fähigkeiten). Im Jahr 2022 entwickelten Miguel Esteban, Stammzellbiologe am Biotech-Unternehmen BGI Cell in Shenzhen (China), und sein Team ein Embryonenmodell, das dem achtzelligen Stadium ähnelt, welches sich normalerweise drei Tage nach der Befruchtung bildet. Im Juni 2024 wiederum stellte Du Peng, Stammzellbiologe an der Universität Peking, ähnliche Zellstrukturen her, die sich zu Blastoiden weiterentwickeln, ohne hierfür mit komplexen Chemikaliencocktails behandelt werden zu müssen.
Aus ethischer Sicht problematisch
Seit dem Auftauchen der ersten Embryonenmodelle weisen Ethiker auf die damit verbundenen moralischen Dilemmata hin. Die Internationale Gesellschaft für Stammzellforschung (ISSCR) hat im Jahr 2021 einschlägige Richtlinien entwickelt. Viele Länder arbeiten an eigenen Leitlinien und Gesetzen.
Zu den strengsten länderspezifischen Vorschriften der Welt gehören die australischen. Der Biochemiker Jose Polo arbeitet an der Monash University in Melbourne und an der University of Adelaide. Im Jahr 2020 informierte er die australische Aufsichtsbehörde für Embryonenforschung sowie den National Health and Medical Research Council darüber, dass er Blastoide entwickelt hatte. Er wurde gebeten, seine Arbeiten einzustellen. Die Aufsichtsbehörde wollte zunächst prüfen, ob Blastoide die Kriterien erfüllen, um nach geltendem Recht als Embryo zu gelten. Die einschlägigen Regularien definieren Embryonen als biologische Objekte, die einen Entwicklungszustand annehmen können, der jenem etwa zwei Wochen nach der Befruchtung entspricht. In dieser Phase erscheint eine frühembryonale Zellstruktur namens Primitivstreifen, und die zweiseitige Körpersymmetrie wird angelegt.
Das Ergebnis der Prüfung ließ rund fünf Monate auf sich warten. Schließlich kam die behördliche Auskunft: Blastoide seien Embryonen ähnlich, da sie theoretisch einen Primitivstrang entwickeln könnten. Folglich würden für sie die gleichen Regularien gelten wie für die Forschung an echten Embryonen.
Umstrittene Entscheidung
Für Polo und seine Mitstreiter war das ein verheerender Rückschlag. Sein Team musste eine spezielle Embryonenlizenz erwerben und durfte Blastoide nicht für Forschungsarbeiten züchten, in denen spätere Stadien der Gastrulation und Organogenese untersucht werden. »Ich glaube, sie haben einen Fehler gemacht«, kommentiert Polo die behördliche Entscheidung. Die Regeln schränken zudem die Zahl der Blastoide ein, die überhaupt hergestellt werden dürfen, und erfordern eine striktere Zustimmung seitens der Menschen, die Zellen für einschlägige wissenschaftliche Arbeiten spenden.
Jedes Land geht mit solchen Fragen anders um. Unterschiede gibt es beispielsweise dahingehend, wie der Begriff »Embryo« definiert wird, ob diese Definition auch Embryonenmodelle einschließt und wie freizügig die einschlägigen Forschungsvorgaben sind. Wenn Regulierungsbehörden über Embryonenmodelle diskutieren, lassen sie sich oft von Regeln leiten, die für die Forschung an echten menschlichen Embryonen gelten, wie Megan Munsie erklärt. Munsie ist Entwicklungsbiologin und Bioethikerin am Murdoch Children's Research Institute in Melbourne.
Derlei Diskussionen gingen häufig über den Bereich der Forschung hinaus und stießen in Fragen der Gesundheit, der Abtreibungsgesetze und der Frauenrechte vor, sagt Alfonso Martinez Arias. Er arbeitet als Entwicklungsbiologe an der Universität Pompeu Fabra in Barcelona, Spanien.
Natürlich oder synthetisch?
Da sich Embryomodelle in vielerlei Hinsicht von ihren realen Vorbildern unterscheiden, werden sie in den meisten Ländern anders behandelt als diese. In Spanien beispielsweise basiert die Definition eines Embryos maßgeblich auf dem Vorgang der Befruchtung. Das schließt Embryonenmodelle aus, die nicht aus der Befruchtung einer Eizelle hervorgehen, wie Nienke de Graeff erläutert, Bioethikerin am Medizinischen Zentrum der Universität Leiden in den Niederlanden.
Einige Definitionen fokussieren auf das Potenzial des Embryos, sich weiterzuentwickeln und dabei grundlegend zu wandeln. Die ISSCR hat erklärt, dass Embryomodelle diesbezüglich nicht mit echten Embryonen vergleichbar seien und deshalb nicht als solche betrachtet werden könnten. In den meisten Staaten vertreten die jeweils zuständigen Organe ähnliche Auffassungen.
Manche Fachleute schlagen vor, die Regularien für den Umgang mit echten Embryonen zu überarbeiten, damit sie Embryonenmodelle einschließen. Ein wissenschaftliches Beratungsgremium in den Niederlanden hat angeregt, das Züchten solcher Modelle über jenes Stadium hinaus zu verbieten, das bei echten Embryonen dem 28. Tag nach der Befruchtung entspricht. Frankreich erwägt die gleiche Begrenzung. Forscher im Vereinigten Königreich beschritten im Juli 2024 einen etwas anderen Weg: Sie veröffentlichten freiwillige Leitlinien für Embryonenmodelle, die keine festen Limits für deren Kultivierungsdauer setzen. Diese Leitlinien könnten zur Verabschiedung verbindlicher Rechtsvorschriften führen.
Die britischen und die ISSCR-Leitlinien von 2021 untersagen den Transfer menschlicher Embryonenmodelle in eine Gebärmutter. Mehrere andere Staaten, darunter Schweden und Japan, erwägen, ähnliche Einschränkungen einzuführen.
Wissenschaft hängt Regulierung ab
Unterdessen schreitet die Forschung mit Embryonenmodellen so schnell voran, dass die Regulierungsbehörden kaum Schritt halten können. Im Juni 2024 gab die ISSCR bekannt, eine Arbeitsgruppe eingesetzt zu haben, um den Stand der Wissenschaft zu bewerten und frühere Leitlinien im Lichte neuer Erkenntnisse zu überprüfen.
Im Lauf des Jahres 2023 stellten mehrere Arbeitsgruppen stammzellenbasierte Modelle vor, welche die embryonale Entwicklung kurz nach der Nidation – dem Einnisten der Blastozyste in die Gebärmutterschleimhaut – nachbilden. Vor allem über zwei dieser Modelle wurde in den Medien berichtet: eines von Fachleuten um Magdalena Zernicka-Goetz, Entwicklungsbiologin am California Institute for Technology in Pasadena, das andere von einem Team um Jacob Hanna, der als Stammzellbiologe am Weizmann Institute of Science im israelischen Rehovot forscht. Mancher Beobachter bezeichnet diese zellulären Gebilde als vollständige Post-Nidations-Modelle, aber ob sie das wirklich sind, ist heftig umstritten.
»Es ist fast wie ein Schönheitswettbewerb, bei dem es darum geht, wessen Modell besser aussieht«Jianping Fu, Bioingenieur
»Sie sind nicht vollständig«, meint beispielsweise Nicolas Rivron. Das Modell der Gruppe um Zernicka-Goetz enthalte keine Zellen, die sich wie Trophoblasten verhalten, welche den Embryo mit Nährstoffen versorgen. Jenes der Gruppe um Hanna wiederum prägt zwar eine trophoblastenähnliche Zellschicht aus, diese ist allerdings anders organisiert als bei echten Embryonen. »Es ist fast wie ein Schönheitswettbewerb, bei dem es darum geht, wessen Modell besser aussieht«, sagt Jianping Fu, Bioingenieur an der University of Michigan in Ann Arbor. »Es gibt viel Aufregung um diese Forschungsarbeiten, doch da schwingt ein gewisser Hype mit.«
Heikler Drahtseilakt
Einige Wissenschaftler bezweifeln den Nutzen, nach einem vollständigen Embryonenmodell zu streben. Denn das Ganze sei ein »ziemlich heikler Drahtseilakt«, wie es Insoo Hyun ausdrückt. Einerseits möchten die Fachleute, dass ihre Modelle einem echten Embryo nahe genug kommen, damit sie wertvolle Einblicke in die Embryogenese liefern. Andererseits soll die Ähnlichkeit nicht derart groß werden, dass kein Unterschied mehr erkennbar ist, denn dann würden Arbeitsrestriktionen drohen. »Man will so nah wie möglich an die Grenze gehen, sie aber nicht überqueren«, sagt Hyun.
Diesem Dilemma lässt sich etwa dadurch entgehen, indem man Embryonenmodelle absichtlich so modifiziert, dass sie sich unmöglich zu einem Organismus weiterentwickeln können. Hanna beispielsweise arbeitet mit Modellen, bei denen Gene ausgeschaltet wurden, die an der Entwicklung des Gehirns und des Herzens mitwirken. Vertreter verschiedener Religionen haben ihm in Gesprächen dargelegt, dass ein Embryomodell ohne Gehirn- und ohne Herzgewebe nicht als menschliche Person anzusehen sei. Eine andere Forschungsgruppe hat ein Modell beschrieben, das zwar in die Phase der Gastrulation eintritt, jedoch ohne einen Primitivstreifen auszubilden.
Vertreter verschiedener Religionen haben dargelegt, dass ein Embryonenmodell ohne Gehirn- und ohne Herzgewebe nicht als menschliche Person anzusehen sei
Solche Zellkonstrukte können aufschlussreich und von großem Nutzen sein. Eines jener Modelle, erstmals vorgestellt im Dezember 2023, hat für Aufsehen gesorgt, weil es einige Aspekte echter Embryonen sehr genau widerspiegelt. Als Mo Ebrahimkhani, Stammzellforscher an der University of Pittsburgh, Pennsylvania, und sein Team das Zellkonstrukt im Laborgefäß züchteten, bemerkten sie, dass es winzige »Blutinseln« ausprägt. Jene Strukturen beherbergen erste Vorläufer der Blutzellen – einschließlich Immunzellen aus der Gruppe der Makrophagen, Thrombozytenvorläufern sowie hämoglobinhaltigen Zellen. Wie die Forschungsgruppe feststellte, lassen sich diese Embryonenmodelle zum Herstellen großer Mengen von Blutstammzellen nutzen, was die Behandlung von Krebskranken oder Menschen mit Erbkrankheiten verbessern könnte.
Organe im Entstehen beobachten
Im Alter von etwa drei Wochen starten menschliche Embryonen den wichtigen Prozess der Organogenese, der Ausprägung der Körperorgane. Diverse Arbeitsgruppen erforschen diesen Entwicklungsabschnitt, indem sie stammzellenbasierte Modelle züchten, die Teile echter Embryonen imitieren. Eine solche »partielle Modellierung« ist ethisch weniger heikel, als den vollständigen Embryo nachzubilden.
Eines der Modelle rekapituliert den rhythmischen Prozess, der die Körpersegmente namens Somiten hervorbringt, aus denen unter anderem die Wirbelknochen entstehen. Ein anderes, vorgestellt von einem Team um Jianping Fu von der University of Michigan, prägt Strukturen ähnlich einem Neuralrohr aus, dem Vorläufer des Zentralnervensystems. Auch diese Modelle sind umstritten. Wenn sie Nervenzellen bilden, wirft das ethische Fragen hinsichtlich ihrer potenziellen Empfindungsfähigkeit auf, wie Hyun anmerkt.
Die nächste große wissenschaftliche Herausforderung besteht darin, Embryonenmodelle in eine Umgebung einzubetten, die der Gebärmutter ähnelt
Die nächste große wissenschaftliche Herausforderung besteht darin, Embryonenmodelle in eine Umgebung einzubetten, die der Gebärmutter ähnelt, und dann zu untersuchen, wie die Zellkonstrukte mit der Gebärmutterschleimhaut interagieren. Bereits bekannt ist: Blastoide, die auf Zellen der Gebärmutterschleimhaut platziert werden, können sich dort in korrekter Weise einnisten. Die gemeinsame Kultivierung von Embryonenmodellen mit gebärmutterähnlichem Gewebe könnte dazu beitragen, dass sich die Modelle mehr wie echte Embryonen entwickeln.
Einige Fachleute gehen sogar noch weiter und arbeiten dafür mit Zellen anderer Spezies, einschließlich nichtmenschlicher Primaten. Liu Zhen ist Entwicklungsbiologe am Institut für Neurowissenschaften der Chinesischen Akademie der Wissenschaften in Schanghai und hat Blastoide von Affen im Laborgefäß gezüchtet, bis sie in die frühe Organogenese eintraten. Im Jahr 2023 setzte Liu solche Blastoide in acht Affen ein, von denen drei daraufhin die Symptome einer frühen Schwangerschaft entwickelten. Um die eingepflanzten Blastoide herum entstanden Fruchtsäcke (flüssigkeitsgefüllte Strukturen, Kennzeichen einer intrauterinen Schwangerschaft), aber dann brach die Entwicklung ab. Blastoide von Kühen und Mäusen, die in Muttertiere ihrer jeweiligen Spezies übertragen wurden, überlebten ebenfalls nicht lange.
Gegenwärtig gibt es keine Vorschriften, die den Transfer nichtmenschlicher Embryonenmodelle in lebende Tiere (mit Ausnahme des Menschen) verbieten. Doch Hyun befürchtet, dass solche Versuche, wenn sie zu einer Lebendgeburt führen, auf großes Unverständnis in der Öffentlichkeit stoßen und Gegenreaktionen auslösen würden, die sich nachteilig auf die Forschung mit Embryonenmodellen auswirken könnten. Es liege ziemlich nahe, bei Experimenten mit (nichtmenschlichen) Affen sofort eine Analogie zum Menschen zu sehen.
Was macht einen Embryo zum Embryo?
Die meisten Forscher stimmen darin überein, dass die heutigen menschlichen Embryonenmodelle mit ihren echten Vorbildern nicht wirklich vergleichbar sind. Die größte Herausforderung beim Entwickeln einschlägiger Richtlinien besteht darin, festzulegen, »ab wann ein solches Modell einem echten Embryo als gleichwertig anzusehen wäre«, wie Amander Clark darlegt. Sie arbeitet als Entwicklungs- und Stammzellbiologin an der University of California in Los Angeles und hat den Kovorsitz der ISSCR-Arbeitsgruppe für Embryomodelle inne.
Ethische Normen verbieten es, menschliche Embryonenmodelle in eine Gebärmutter zu übertragen, um zu prüfen, ob sie einen Organismus hervorbringen können. Daher testen die Fachleute das anhand anderer Kriterien. Einige Arbeitsgruppen entwickeln Methoden, um die Modelle besser mit echten Embryonen zu vergleichen, etwa indem sie die RNA-Profile der Zellen untersuchen. Aber selbst solche modernen Verfahren liefern nicht alle wichtigen Informationen – zum Beispiel nicht die Position der Zellen innerhalb des Embryos.
»Es ist sehr wichtig, dass wir keine Zeit mit schlechten Modellen verschwenden«Fredrik Lanner, Stammzell- und Entwicklungsbiologe
Embryonenmodelle fortlaufend zu bewerten und zu verbessern, sei sowohl im Sinn der Wissenschaft als auch der Ethik wichtig, betont Fredrik Lanner, der als Stammzell- und Entwicklungsbiologe am Karolinska-Institut in Stockholm arbeitet. »Es ist sehr wichtig, dass wir keine Zeit mit schlechten Modellen verschwenden.« Derweil liefert die Forschung immer tiefere Einblicke in die frühe Embryonalentwicklung, wobei es so manche Überraschung gibt. Für besonders bemerkenswert halten Expertinnen und Experten die große Wandlungsfähigkeit embryonaler Zellen – ihre Plastizität – sowie ihre Fähigkeit, sich selbst zu organisieren, oft ohne die Hilfe von außerembryonalem Gewebe.
Immer wieder gelingt es, den Modellen neue Eigenschaften zu verleihen. So ist schon seit Längerem bekannt, dass die Embryonen einiger Säugerarten eine Art Winterschlaf halten, falls die Befruchtung im Sommer stattgefunden hat, und ihre Entwicklung dann zeitverzögert fortsetzen, so dass die Jungtiere im Frühjahr auf die Welt kommen. Rivron und seinem Team ist es geglückt, menschliche Blastoide in einen solchen Entwicklungsstillstand zu versetzen.
Bislang hätten Embryonenmodelle noch nicht zu gesellschaftlich relevanten wissenschaftlichen Entdeckungen geführt, sagt Rivron. Und es sei nicht klar, ob es in Zukunft dazu kommen werde. Klar geworden sei aber: Obwohl jedes Modell sei auf seine Weise unvollkommen ist, sind alle nützlich. »Es kommt nur darauf an, welche Fragen man stellt.«

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.