Nobelpreise: Pünktlich von A nach B
Wenn es schnell gehen soll, reden Forscher und Berichterstatter ja gerne kurz und knapp vom "Medizin"-Nobelpreis – obwohl der ja offiziell und explizit auch eine "Physiologie"-Auszeichnung sein kann. Das hatte bei der Preisverkündung in Stockholm in diesem Jahr offenbar nicht jeder im Auditorium auf dem Zettel: eine Auszeichnung für zellphysiologische Grundlagenforschung? Die für viele unerwartete Wahl des Nobelkomitees sorgte also erst einmal für ein wenig Ratlosigkeit, verstohlenes Schulterzucken und eine vergleichsweise kurze Nachfragerunde im Anschluss an die Verkündung. Dabei haben die jetzt preisgewürdigten Studien der frischgebackenen Laureaten Randy Schekman, James Rothman und Thomas Südhof einen ebenso eleganten wie grundlegenden Mechanismus aller höher entwickelten Zellen enträtselt: die Maschinerie des "vesikulären Transportsystems". Sie sorgt dafür, dass alles, was in der Zelle entsteht, immer auch dort landet, wo es hingehört – und dies weder zu spät noch zu früh. Kein Wunder, dass ein Holpern im universellen Zelltransport auch vielfältigste medizinische Folgen nach sich zieht: Es kann etwa eine Ursache von Diabetes oder neurologischen und immunologischen Störungen sein.
Die Zellen höherer Organismen, der Eukaryonten, unterscheiden sich von ihren einfacher gebauten Prokaryonten-Vettern in ein paar wesentlichen Punkten. Vor allem sind sie komplexer. Ihre deutliche Unterteilung in Kompartimente – durch Membranen abgeschlossene Abteilungen wie den Zellkern oder die Mitochondrien – schafft getrennte und unabhängige Reaktionsräume, in denen parallel verschiedene Spezialprozesse viel kontrollierter abgewickelt werden können, als es in einem großen Gefäß möglich wäre, in dem alle für alle Reaktionen nötigen Ausgangstoffe unsortiert, gut gemischt durcheinanderwirbeln. Aber kein Vor- ohne Nachteil: Die speziellen Reaktionsräume müssen verlässlich nur mit den für sie bestimmten Spezialmolekülen versorgt werden. Eukaryontische Zellen brauchen also ein ausgefeiltes Logistiksystem, das etwa zwischen den Zulieferabteilungen und der Endmontagehalle vermittelt – und am Schluss auch dafür sogt, dass ein fertiges Endprodukt – etwa ein Hormon oder ein Neurotransmitter – aus der Zelle exportiert wird, sobald es draußen gefordert ist.
Wie die Transportmaschine aussehen könnte, hatten Forscher nach mühsamen mikroskopischen Untersuchungen in den 1970er Jahren zu vermuten begonnen: Offensichtlich wandern zwischen den membranumhüllten Kompartimenten der Zellen kleine membranumhüllte Vesikel umher; sie schnüren sich aus einem Membrankompartiment ab, wandern zu einem anderen und fusionieren mit der dortigen Membran, wobei sie die im Inneren umhüllte Fracht in das Zielkompartiment ausschütten. Forscher wie der deutschstämmige US-Forscher Günther Blobel hatten auch erkannt, dass frisch in den ribosomalen Proteinfabriken produzierte Eiweiße mit einer Art innerem Adressaufkleber etikettiert werden, der ihren Zielort in der Zelle enthält – Blobel erhielt für diese Entdeckung den Nobelpreis 1999.
Aber wie ist der Adressaufkleber der Vesikel beschaffen, in denen dann etwa bestimmte Proteine umhüllt sind? Was informiert die Bläschen darüber, ob sie ihren Inhalt durch die äußere Zellhülle schleusen oder aber zur Weiterverarbeitung in die Membransäckchen des Golgi-Apparates transportieren sollen?
Vesikel-Reißverschluss
Der 1948 im US-Bundesstaat Minnesota geborene Randy Schekman – er lehrt heute an der University of California in Berkeley – hatte in den späteren 1970er Jahren die damals noch wenig etablierte Idee verfolgt, in einem vergleichsweise leicht handhabbaren Modellorganismus nach genetischen Grundlagen des mysteriösen zellulären Transportmechanismus zu suchen: in der Bier- und Bäckerhefe Saccharomyces cerevisiae. Dabei arbeitete er schließlich heraus, dass 23 so genannte sec-Gene an der Regulation des Vesikeltransports in der Hefezelle beteiligt sind. Mutationen in solchen Genen sorgten etwa dafür, dass Eiweiße sich ungeordnet irgendwo im Zellinneren ansammelten. Zudem schienen sich die 23 Gene in drei Klassen zu ordnen, die den Transport zu drei möglichen Zielorten verantworten: dem Zelläußeren, dem Endoplasmatischen Retikulum und dem Golgi-Apparat. Der Zelltransport hat, wie wir seit Schekmans Arbeit wissen, also eine relativ übersichtliche genetische Grundlage.
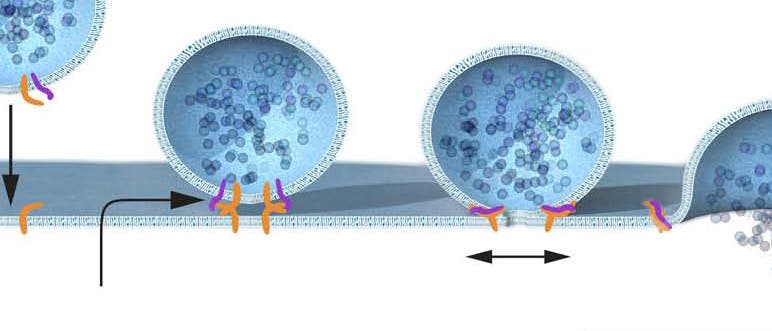
An diese Erkenntnis dockte nur wenig später die Forschung von James Rothman an. Der 1950 in Maryland, USA, geborene Biochemiker, heute an der Yale University, erreichte seinen Durchbruch in den 1980er Jahren allerdings nicht mit Hefen, sondern im Reagenzglas. In einem clever dem natürlichen Vorbild nachgestellten biochemischen Vesikeltransportsystem fand er verschiedene Proteine, die im Zytoplasma der Zellen enthalten sind und für den Transport der Membranvesikel sorgen – sowie dazu passende Eiweiße in den Membranen, an die diese Zytoplasmaproteine binden.
Nach einem guten halben Jahrzehnt der Forschung hatte Rothmans Arbeitsgruppe dann schließlich die biochemischen Grundlagen von Vesikelabschnürung, -transport und –fusion in feinen Details aufgedröselt. Dabei entstand die bis heute im Wesentlichen akzeptierte "Snare-Hypothese": Sie erklärt, wie sekretorische Zellen ihre Transportvesikel im Inneren zur äußeren Membran leiten, um den zu exportierenden Inhalt dann dort gezielt nach außen zu schütten. Demnach enthalten die Vesikelmembranen und die Membran an der Andockstelle spezifisch zueinander passende Proteinkomplexe, die wie zueinander passende Hälften eines Reißverschlusses arbeiten.
Wie die Vesikel geleitet werden, war nun relativ klar: Bestimmte Vesikelmembranproteine passen nur zu ganz bestimmten Membranproteinen in der äußeren Zellhülle oder eben der Hülle anderer Zielorte in der Zelle, etwa dem Golgi-Apparat. Zusammen hatten Schekman und Rothman Anfang der 1990er dann auch herausgearbeitet, dass die von Rothman gefundenen Säugetierproteine durch Gene kodiert werden, die den von Schekman entdeckten sec-Genen aus Hefen analog sind: Offenbar arbeiten Hefen und Säuegetierzellen ganz ähnlich, der Transportmechanismus eukaryontischer Zellen muss also evolutionär uralt sein.
Just-in-time und eine Klammer
Eine Frage blieb offen: Wie gelingt es dem Logistiksystem der Zelle, nicht nur den Zielort eines Transportgutes zu regeln, sondern auch den Auslieferungszeitpunkt? Eine fein justierbare und pünktliche Ausschüttung ist etwa bei Nervenzellen unabdingbar: Sie müssen ihre Transmittersubstanzen bei der Weiterleitung der Signale pünktlich immer genau dann ausliefern, wenn ein neuronales Signal eines vorgeschalteten Neurons dies vorgibt. In dieses Problem hatte sich seit den 1990er Jahren der dritte Preisträger verbissen. Thomas Südhof, 1955 in Göttingen geboren und heute an der Universität Stanford, arbeitete damals nach seiner Ausbildung am Max-Planck-Institut für biophysikalische Chemie in Göttingen an der UT-Southwestern in Dallas, Texas, und beschäftigte sich mit der Rolle, die Kalziumionen bei dem Prozess, der Exozytose synaptischer Vesikel von Nervenzellen, spielen.
Die Ca2+-Ionen werden in den Zellen ausgeschüttet, kurz bevor die prall mit Transmittern gefüllten synaptischen Vesikel mit der Membran fusionieren. Offensichtlich mussten die Ionen an einen vermittelnden Rezeptor binden, um ein Ausschüttungssignal auszulösen. Südhof entdeckte, dass etwas Derartiges tatsächlich geschieht: Kalzium dockt an ein Sensorprotein namens Synaptotagmin an, welches dann an der reißverschlussähnlichen Fusionsstelle zwischen äußerer Neuronenmembran und der Vesikelmembran aktiv wird. Gleichzeitig gibt ein zweites von Südhof beschriebenes Protein seine Position an dieser Stelle auf: Complexin, von dem angenommen wird, dass es den Membranreißverschluss wie eine Klammer zusammenhält. Unter dem Einfluss von Kalzium und mit Hilfe von Synaptotagmin wird diese Klammer nun gelöst. Die Membranfusion beginnt, die Transmitter werden freigesetzt und das Nervensignal weitergeleitet – pünktlich in dem Augenblick, in dem die Kalziumausschüttung den Startpunkt setzt.
Transportproblem macht Chaos
Die Ausschüttung von Neurotransmittern ist aber nur in einer Hinsicht ein Sonderfall des vesikularen Zelltransports: Sie ist besser untersucht als die sicher ähnlichen Mechanismen, die bei allen räumlich und zeitlich regulierten Vesikelfusionen in der Zelle ablaufen. Die Logistikmaschinerie spielt nicht nur bei der Signaltransduktion an der neuronalen Synapse eine wichtige Rolle, sondern auch im Hormonsystem – etwa bei der Abgabe von Insulin –, oder im Immunsystem, bei der Bekämpfung von Krankheitserregern durch freigesetzte Moleküle der Körperabwehr.
Kein Wunder also, dass ein Ausfall der beteiligten Systeme beim Menschen auch eine ganze Reihe von unterschiedlichen Krankheiten nach sich zieht. So sind bestimmte Formen der Epilepsie wohl mit einem Versagen der menschlichen Version eines Transportsystemgens korreliert, die schon Schekman in Hefen gefunden hatte. Ein anderes solches Gen verursacht – in defekter Form – eine schwere Autoimmunerkrankung: Am falschen Ort zur falschen Zeit von den natürlichen Killerzellen abgegebene Immunmodulatoren lösen Attacken auf die eigenen Körperzellen aus. Und auch bestimmte Bakterienerkrankungen haben mit dem Funktionieren oder Versagen des Vesikeltransports zu tun. Das vom Tetanuserreger freigesetzte Toxin blockiert zum Beispiel die Vesikelausschüttung in bestimmten Neuronen und sorgt so für die typischen Spasmen, die mit der Krankheit einhergehen.
Das sind nur einige wenige Beispiele allein der bekannten Folgen eines Ausfalls des Universaltransportsystems der Zellen. Eine Fehlregulation des in so vielen physiologischen Prozessen involvierten Transportsystems, so das Nobelpreiskomitee, produziert in den Zellen nur noch eines: Chaos – mit allen möglichen Konsequenzen. Also Grund genug, für die zellphysiologischen Grundlagenforschung von Rothman, Schekman, und Südhof auch den Medizinnobelpreis zu verleihen.

Schreiben Sie uns!
Beitrag schreiben