Biochemie: Pannenschutz bei Antibiotikasynthese
© Philipps-Universität Marburg/AG Marahiel (Ausschnitt)
Mikroorganismen stellen kurze Ketten von Aminosäuren, so genannte Peptide, in großer Vielfalt her. Viele der entstehenden Produkte kommen wiederum als Wirkstoffkandidaten für neue Antibiotika in Frage. Forscher versuchen daher, den Syntheseprozess zu verstehen, um eines Tages maßgeschneiderte Substanzen herstellen zu können.
Dieser Prozess gleicht einer Fließbandproduktion: An mehreren, hintereinander geschalteten "Montageplätzen" wird jeweils ein bestimmtes Bauteil (Aminosäure) in das entstehende Produkt, nämlich das Antibiotikum, eingebaut. Die Aufgabe des Förderbands übernehmen spezielle Transport-Eiweiße (Peptidyl-Carrier-Proteine, PC-Proteine). Diese docken über einen so genannten Ko-Faktor an die Syntheseprodukte an und leiten sie zur nächsten Station weiter.
Oft jedoch ist der Ko-Faktor chemisch so modifiziert, dass er seinen Zweck nicht erfüllen kann – das Andocken scheitert. Mit dem Enzym Thioesterase II, das die Ko-Faktoren "reparieren" kann, verfügt der Körper aber über eine effektive Pannenhilfe. Fehlt das Enzym, so sinkt die Ausbeute der Synthese um 84 Prozent.
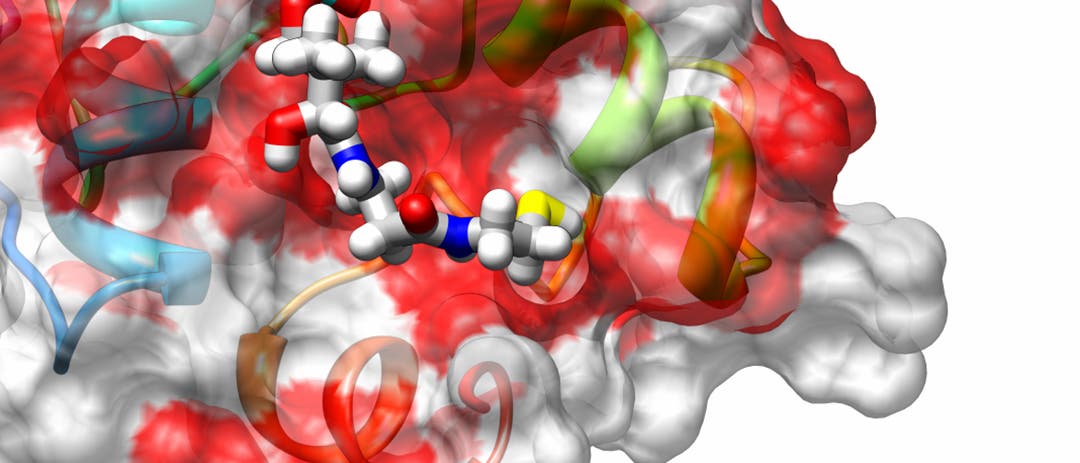
Zwei Teams der Universitäten Marburg und Frankfurt ist es nun am Beispiel des Heubazillus (Bacillus subtilis) gelungen, mit Hilfe der NMR-Spektroskopie die dreidimensionale molekulare Struktur der Thioesterase II und des Komplexes, der aus der Kombination dieses Enzyms mit einem PC-Protein entsteht, zu ermitteln.
So konnten sie erstmalig Einzelheiten der Funktionsweise des Pannenservices klären. Unter anderem stellten sie fest, dass das aktive Zentrum des Reparaturenzyms mit einer Vielfalt anderer Strukturen interagieren kann und so eine „unspezifische, aber unverzichtbare Reparaturfunktion“ erfüllt.
Jan Hattenbach
Dieser Prozess gleicht einer Fließbandproduktion: An mehreren, hintereinander geschalteten "Montageplätzen" wird jeweils ein bestimmtes Bauteil (Aminosäure) in das entstehende Produkt, nämlich das Antibiotikum, eingebaut. Die Aufgabe des Förderbands übernehmen spezielle Transport-Eiweiße (Peptidyl-Carrier-Proteine, PC-Proteine). Diese docken über einen so genannten Ko-Faktor an die Syntheseprodukte an und leiten sie zur nächsten Station weiter.
Oft jedoch ist der Ko-Faktor chemisch so modifiziert, dass er seinen Zweck nicht erfüllen kann – das Andocken scheitert. Mit dem Enzym Thioesterase II, das die Ko-Faktoren "reparieren" kann, verfügt der Körper aber über eine effektive Pannenhilfe. Fehlt das Enzym, so sinkt die Ausbeute der Synthese um 84 Prozent.
Zwei Teams der Universitäten Marburg und Frankfurt ist es nun am Beispiel des Heubazillus (Bacillus subtilis) gelungen, mit Hilfe der NMR-Spektroskopie die dreidimensionale molekulare Struktur der Thioesterase II und des Komplexes, der aus der Kombination dieses Enzyms mit einem PC-Protein entsteht, zu ermitteln.
So konnten sie erstmalig Einzelheiten der Funktionsweise des Pannenservices klären. Unter anderem stellten sie fest, dass das aktive Zentrum des Reparaturenzyms mit einer Vielfalt anderer Strukturen interagieren kann und so eine „unspezifische, aber unverzichtbare Reparaturfunktion“ erfüllt.
Jan Hattenbach

Schreiben Sie uns!
Beitrag schreiben