Katalyse: Ungewöhnlicher Gast im Metallcluster
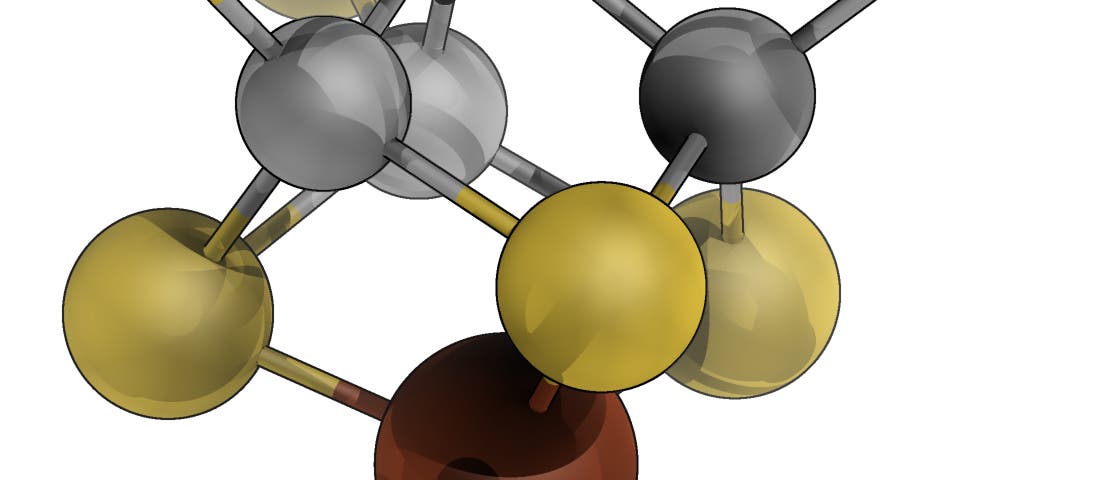
Im aktiven Zentrum der Nitrogenase entdeckten Wissenschaftler zu Beginn der 1990er Jahre einen metallhaltigen Cofaktor, an dem die Reaktion stattfindet. Neben Eisen enthält der so genannte FeMoCo-Cluster ein Molybdänatom, das, so vermuten Forscher seither, für die Katalyse entscheidend ist. 2003 gelang einem Team um den späteren Chemie-Nobelpreisträger Richard Schrock der Nachweis, dass auch künstliche Molybdänkomplexe in der Lage sind, Distickstoff zu Ammoniak umzusetzen.
Nach einem technisch nutzbaren Katalysator allerdings, der die energieintensive Haber-Bosch-Reaktion in großem Maßstab ablösen konnte, suchen Forscher seither vergeblich. Tatsächlich ist nicht einmal bekannt, wie die Nitrogenase selbst ihr chemisches Kunststück vollbringt. Für genauere Untersuchungen, auch auf Basis von Modellrechnungen, fehlte bislang ein Puzzlestück: die Identität eines möglicherweise entscheidenden Atoms.
Im Herzen des katalytischen Zentrums aus Eisen, Schwefel und Molybdän sitzt ein über zehn Jahre lang unidentifiziertes Atom – gut versteckt hinter anderen Atomen, genau in der Mitte der Struktur. Erste Messungen schienen 2002 darauf hinzudeuten, dass es sich dabei um ein Stickstoffatom handeln könnte – und dass diese zentrale Position das katalytische Zentrum selbst sein könnte, an dem die Bindung zwischen den beiden Stickstoffatomen gebrochen wird.
Doch damit waren die Wissenschaftler auf dem falschen Dampfer. Aktuelle Messungen mit verschiedenen Verfahren zeigen, dass das Zentrum des Nitrogenase-Clusters einen viel ungewöhnlicheren Gast enthält.[1] Ein Team um Oliver Einsle von der Universität Freiburg, die bereits 2002 eine Röntgenstrukturanalyse der Nitrogenase veröffentlicht und das Vorhandensein des mysteriösen Atoms belegt hatten, trennten das Protein und sein aktives Zentrum mit einem verbesserten Verfahren von anderen Stoffen ab und züchteten aus ihm einen Kristall, der reiner ist als alle zuvor erhaltenen Exemplare. Dieser Fortschritt macht es möglich, per Röntgenbeugung die Struktur mit einer Auflösung von 1,0 Angström statt wie zuvor 1,16 Angström darzustellen.
Dieses Ergebnis bestätigen auch spektroskopische Untersuchungen. Das Freiburger Team markierte Nitrogenase des Bakteriums Azotobacter vinelandii mit Kohlenstoff-13, der Signale in der Kernresonanzspektroskopie erzeugt. Diese konnten die Forscher dann sicher einem Kohlenstoff am oder im Komplex zuordnen; kein anderer Kohlenstoff kommt dem Komplex nahe genug, um diese Signale zu erzeugen. Unabhängig davon untersuchte eine zweite Gruppe die gleiche Fragestellung [2] – allerdings mit Hilfe der Röntgenemissionsspektroskopie (XES). Dabei schlägt weiche Röntgenstrahlung Elektronen aus der innersten Schale von Metallatomen heraus – diese werden durch andere Elektronen aus den Schalen benachbarter Atome ersetzt, die dabei selbst Röntgenstrahlung mit einem für die chemische Umgebung charakteristischen Spektrum aussenden. Das Team um Serena DeBeer vom Max-Planck-Institut für Bioanorganische Chemie an Mülheim an der Ruhr verglich das XES-Spektrum des aktiven Komplexes mit dem des P-Clusters, in dem das zentrale Atom durch Schwefel ersetzt ist.
Entscheidend für die Identifizierung ist auch hier ein Simulationsverfahren: Die Forscher berechneten die Differenz simulierter Spektren des katalytischen Zentrums mit C, N und O zum simulierten Spektrum des P-Clusters. Mit dieser Differenz glichen sie die tatsächlich gemessenen Daten ab und stellten fest, dass sich die Differenzspektren je nach Zentralatom eindeutig unterscheiden. Auch hier passen die Messdaten eindeutig zu einem Kohlenstoffatom im Zentrum.
Die Entdeckung ist so ungewöhnlich, dass sie vorerst mehr Fragen aufwirft als sie beantwortet – zu allererst natürlich nach der Funktion des Zentralatoms: Der eng verwandte P-Cluster, der Elektronen zum aktiven Zentrum transportiert, hat eine sehr ähnliche Struktur – doch in seinem Zentrum befindet sich ein Schwefelatom, so dass alle Brückenpositionen zwischen Metallatomen von Schwefel eingenommen werden. Viele Eisen-Schwefel-Proteine des Zellstoffwechsels teilen diese Struktur.
Warum also weicht der Molybdänkomplex von dieser bewährten Struktur ab, und dann noch auf so ungewöhnliche Weise? Und wie wird dieses ungewöhnliche Kohlenstoffatom bereitgestellt? Schon Kohlenstoff-Metall-Bindungen kommen in klassischen Biomolekülen eigentlich nicht vor, und ihre Herstellung ist energetisch sehr aufwändig – ganz abgesehen davon, dass keine Biosynthese bekannt ist, die etwas derartiges erzeugen könnte.
All das, und dass es bis jetzt noch nicht gelungen ist, einen auch nur ansatzweise zufriedenstellenden künstlichen Katalysator für die Reaktion herzustellen, deutet darauf hin, dass das Zentralatom weit mehr ist als nur eine Stützstrebe für den Cluster – womöglich spielt es, direkt oder indirekt, eine entscheidende Rolle bei der Reaktion selbst. Aber welche das sein könnte, und wie man die Funktion der Nitrogenase technisch nachempfinden kann, ist nach der Entschlüsselung der Struktur unklarer denn je. Der Eisen-Molybdän-Kofaktor der Nitrogenase ist nicht nur das größte und komplexeste bislang bekannte Metallzentrum der Biologie, sondern nach wie vor das geheimnisvollste. (lf)

Schreiben Sie uns!
Beitrag schreiben