Zytologie: Zellreifung per Selbstmord-Enzym
© Y. Hayashizaki, K. Tsukimoto (Ausschnitt)
Der programmierte Zelltod zählt zu den grundlegenden Lebensfunktionen höherer Organismen: Er kontrolliert Größe und Form von Geweben und entfernt infizierte oder entartete Zellen. Unvollständig ausgeführt, erfüllt der gleiche Mechanismus jedoch offenbar auch eine ganz andere Aufgabe: Er hilft mit bei der Differenzierung von Stammzellen, also ihrer Spezialisierung auf eine bestimmte Funktion. Das entdeckten Mediziner um Brian Larsen von der Universität Ottawa.
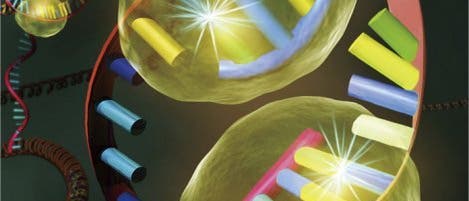
Andere Forschergruppen hatten zuvor schon bemerkt, dass bei der Reifung verschiedener Zelltypen vermehrt Brüche in deren DNA-Strängen auftraten. Diese werden, wie Larsen und seine Kollegen nun an Vorläuferzellen von Muskeln feststellten, gezielt durch das Enzyms CAD (Capase activated DNAse) verursacht, das auch während des programmierten Zelltods die Chromosomen zerschneidet. Anders als bei der zellulären Selbstzerstörung treten die Schäden jedoch nicht an willkürlichen Stellen des Erbguts auf, sondern konzentrieren sich auf ein Gen, das die Differenzierung von Zellen steuert. Zudem schließen Reparaturenzyme die Lücke im DNA-Strang immer schnell wieder. Das Paradoxe daran: Das wiederholte Zerschneiden und erneute Zusammenfügen des Gens legt es nicht etwa lahm, sondern lässt seine Aktivität steigen.
Die Forscher erklären das damit, dass die DNA normalerweise in einem kompakten, aufgewickelten Zustand vorliegt, in dem ihr Inhalt größtenteils unzugänglich ist. Durch das wiederholte Zerschneiden und Zusammenfügen eines Abschnitts könnte der Erbfaden an dieser Stelle aufgerollt werden, wodurch sich Ableseenzyme anlagern können. Weitere Untersuchungen müssen nun erweisen, ob es sich bei dem Vorgang womöglich um einen verbreiteten, bisher unbekannten Weg der Genregulation handelt.
Ralf Strobel
Andere Forschergruppen hatten zuvor schon bemerkt, dass bei der Reifung verschiedener Zelltypen vermehrt Brüche in deren DNA-Strängen auftraten. Diese werden, wie Larsen und seine Kollegen nun an Vorläuferzellen von Muskeln feststellten, gezielt durch das Enzyms CAD (Capase activated DNAse) verursacht, das auch während des programmierten Zelltods die Chromosomen zerschneidet. Anders als bei der zellulären Selbstzerstörung treten die Schäden jedoch nicht an willkürlichen Stellen des Erbguts auf, sondern konzentrieren sich auf ein Gen, das die Differenzierung von Zellen steuert. Zudem schließen Reparaturenzyme die Lücke im DNA-Strang immer schnell wieder. Das Paradoxe daran: Das wiederholte Zerschneiden und erneute Zusammenfügen des Gens legt es nicht etwa lahm, sondern lässt seine Aktivität steigen.
Die Forscher erklären das damit, dass die DNA normalerweise in einem kompakten, aufgewickelten Zustand vorliegt, in dem ihr Inhalt größtenteils unzugänglich ist. Durch das wiederholte Zerschneiden und Zusammenfügen eines Abschnitts könnte der Erbfaden an dieser Stelle aufgerollt werden, wodurch sich Ableseenzyme anlagern können. Weitere Untersuchungen müssen nun erweisen, ob es sich bei dem Vorgang womöglich um einen verbreiteten, bisher unbekannten Weg der Genregulation handelt.
Ralf Strobel

Schreiben Sie uns!
Beitrag schreiben