Evolution: Mit Darwin gegen die Antibiotikakrise
Dieser Artikel ist Teil eines Projekts des KielSCN und »Spektrum.de« mit dem Ziel, neue Ansätze für interaktive Wissenschaftskommunikation zu entwickeln. Sind Sie interessiert? Dann helfen Sie mit, die Infografiken zu verbessern!
- Vergleichen Sie die verschiedenen Versionen von Abb. 1, fahren Sie mit der Maus über Abb. 2 und beobachten Sie, wie sich die Grafik verändert, oder stellen Sie hier Ihre persönliche Darstellungsversion direkt selbst ein.
- Steigen Sie tiefer ein und arbeiten Sie unmittelbar an der Konzeption der Infografiken (Coding). Dazu einfach dem hinterlegten Link bei »Living Lab« folgen, der sich unter jeder Infografik findet, und auf der Plattform Observable kostenfrei anmelden.
Wir freuen uns über Ihr Feedback! Schreiben Sie uns einfach über das Kontakt-Feld am Ende des Artikels.
An einem der ersten heißen Sommertage geht Ann-Kathrin mit ihren Freunden im Baggersee schwimmen und zieht sich dort eine Ohreninfektion zu. Kurz darauf beginnen die Schmerzen: zunächst nur links, dann beidseitig. Ann-Kathrin sucht eine HNO-Praxis auf, wo ihre Ohren gereinigt werden. Als das nicht hilft, bekommt sie Tropfen verschrieben mit dem Wirkstoff Ciprofloxacin, einem Antibiotikum aus der Gruppe der Fluorchinolone. Kurzzeitig bessert sich ihr Zustand, dann aber kehrt der Schmerz zurück. Weitere Untersuchungen ergeben, dass sie sich mit multiresistenten Bakterien der Spezies Pseudomonas aeruginosa infiziert hat, die unempfindlich gegen mehrere Arzneimittel geworden sind.
Der Fall Ann-Kathrins steht beispielhaft für viele. Infektionen mit multiresistenten Keimen sind weltweit auf dem Vormarsch und stellen die Gesundheitssysteme vor immer größere Herausforderungen. Das geht aus Erhebungen etwa der Weltgesundheitsorganisation oder des Robert Koch-Instituts hervor. Wie konnte es dazu kommen?
Krankheitserreger bedrohen den Menschen seit jeher. Hierzu gehören Viren, Bakterien, Pilze und einzellige Parasiten. Im Lauf der Jahrtausende haben sie immer wieder Infektionswellen verursacht, sowohl weltweite (Pandemien) als auch örtlich-regional beschränkte (Epidemien). Ein historisches Beispiel hierfür ist der Schwarze Tod, die Pest, die – ausgelöst vom Bakterium Yersinia pestis – vor allem im 14. Jahrhundert wütete und etwa ein Drittel der europäischen Bevölkerung das Leben kostete. Wiederholte Pockenausbrüche in Amerika, die nach Ankunft der Spanier im 16. Jahrhundert aufflammten, rafften Abermillionen Indigene dahin. Und Anfang des 20. Jahrhunderts forderte die Spanische Grippe weltweit zirka 50 Millionen Tote. Die Covid-19-Pandemie schließlich hat unser Leben in den zurückliegenden Jahren erheblich geprägt und mit rund sieben Millionen Opfern eine Spur des Todes gezogen.
Noch im 19. Jahrhundert gehörte es zum Alltag, dass in den Familien nicht alle Geschwister überlebten: 40 bis 50 Prozent der Kinder starben vor Vollendung der Pubertät, meist an Infektionskrankheiten. Im Jahr 1921 erlagen rund 16000 Kinder in den USA allein der Diphterie; hinzu kamen die Opfer der Kinderlähmung, des Keuchhustens, der Pocken und vieler weiterer Krankheiten. Diese Situation hat sich auf Grund zweier Innovationen verbessert: zum einen wegen der Einführung der Massenimpfungen ab dem späten 19. Jahrhundert, die virale Erkrankungen stark zurückdrängen. Zum anderen wegen der Entwicklung antibiotischer Arzneistoffe im 20. Jahrhundert, die gegen bakterielle Keime wirken. Beide gehören zu den großen Erfolgsgeschichten der Medizin, da sie in den zurückliegenden Jahrzehnten hunderte Millionen infektionsbedingte Todesfälle verhindert haben.
Ein Zufallsfund, der Leben rettete
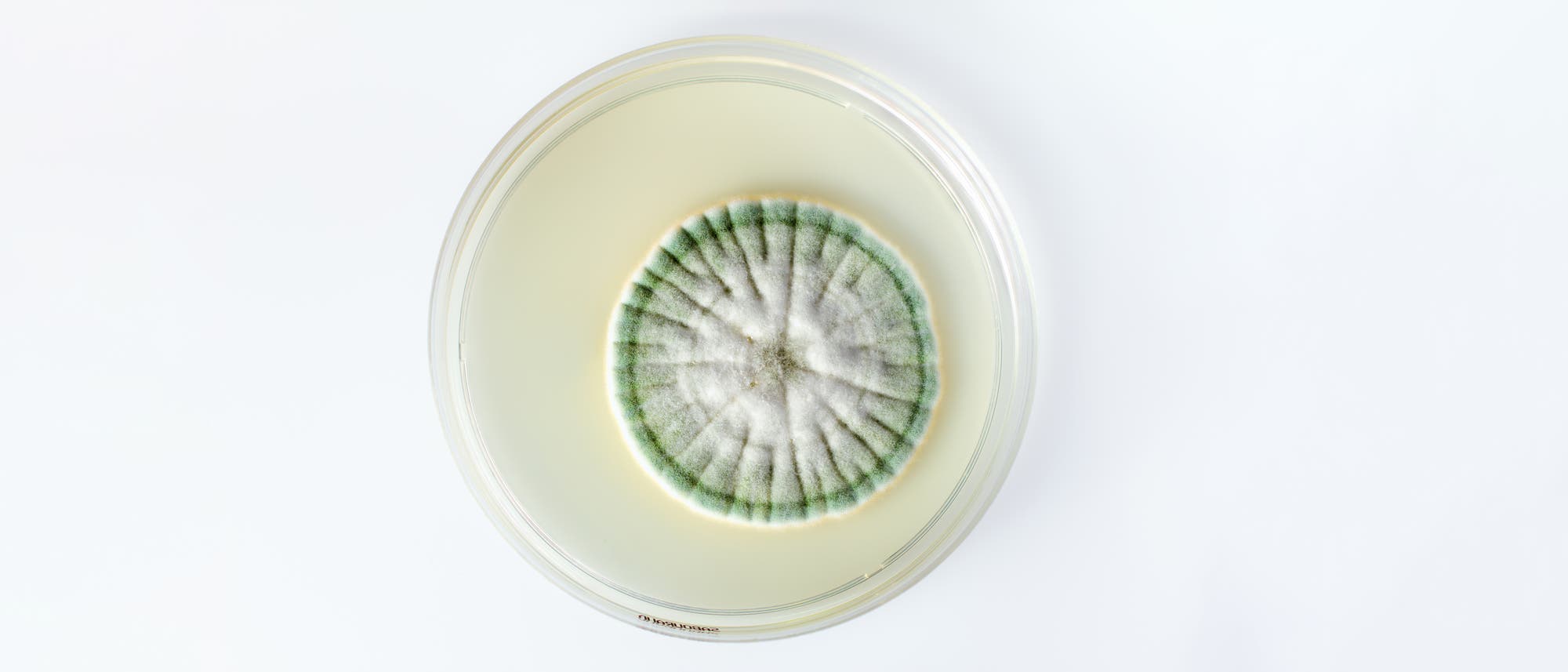
Antibiotika sind natürlich vorkommende oder synthetische Substanzen, die Bakterien abtöten beziehungsweise an der Vermehrung hindern. Schon im späten 19. Jahrhundert begannen Forscher zu untersuchen, wie sich bakterielle Infektionen ursächlich bekämpfen lassen. Eines der ersten Antibiotika war Penizillin, das der britische Mediziner Alexander Fleming (1881–1955) im Jahr 1928 zufällig entdeckte. Er bemerkte, dass ein Schimmelpilz, der eine seiner Bakterienkulturen in der Petrischale kontaminiert hatte, das Wachstum der Mikroben hemmte. Weitere Nachforschungen ergaben, dass der Pilz mit der Artbezeichnung Penicillium notatum eine Substanz produziert, die Mikroorganismen abtötet. Der Stoff erhielt den Namen Penizillin.
Zu Beginn war es schwierig, Penizillin in großen Mengen herzustellen. Daher diente als erstes massenhaft eingesetztes Antibiotikum eine synthetische Verbindung aus der Gruppe der Sulfonamide, die ursprünglich als Farbstoff in der Textilindustrie eingesetzt worden war. Der deutsche Mediziner Gerhard Domagk (1895–1964) entwickelte sie in den 1930er Jahren zum antibiotischen Medikament weiter, das unter dem Handelsnamen Prontosil auf den Markt kam. In den Jahrzehnten darauf folgten weitere einschlägige Arzneistoffe, darunter Streptomycin, Tetracyclin und Erythromycin. Sie revolutionierten die Medizin und ermöglichten es, bakterielle Infektionen zu behandeln, die zuvor unheilbar gewesen waren – etwa die Tuberkulose. Dank der Antibiotika konnten Ärzte nun auch weitgehend gefahrlos operative Eingriffe vornehmen, die mit einem hohen Infektionsrisiko behaftet sind.
Allerdings dauerte es nicht lange, bis sich ein neues Problem abzeichnete: Krank machende Keime wurden gegen die Wirkstoffe zunehmend unempfindlich. Dass das passieren könnte, darauf hatte bereits Alexander Fleming hingewiesen. In seiner Rede zum Erhalt des Nobelpreises, den er 1945 für die Entdeckung des Penizillins bekam, warnte er nachdrücklich: »Es ist nicht schwer, Mikroben im Labor resistent gegen Penizillin zu machen, indem man sie Konzentrationen aussetzt, die nicht ausreichen, um sie abzutöten, und dasselbe ist gelegentlich im Körper passiert.« Heute wissen wir, dass der Einsatz von Antibiotika in der Humanmedizin wie in der Tierhaltung massiv zur Evolution und Ausbreitung resistenter Pathogene beiträgt.
Bakterien sind Meister der Evolution. Dank ihrer kurzen Generationsdauer, ihrer in der Regel riesigen Populationen und ihres variablen Genoms passen sie sich üblicherweise sehr schnell an neue Umweltbedingungen an. Darum finden wir praktisch überall Mikroben – selbst an Orten, die durch extreme Temperaturen, Salzgehalte, pH-Werte oder eine hohe Strahlenbelastung gekennzeichnet sind. Sich an Antibiotika zu adaptieren, stellt für sie eine eher kleine Hürde dar.
Es gibt verschiedene Möglichkeiten, wie ein Mikroorganismus so evolvieren kann, dass er arzneimittelresistent wird. Durch genetische Mutationen kann sich der Angriffspunkt – beispielsweise ein Membranmolekül – verändern, auf den das jeweilige Antibiotikum zielt. Das macht den Wirkstoff häufig ineffektiv. Eine weitere Möglichkeit: Das Bakterium entwickelt ein Enzym, das den Arzneistoff direkt zerstört. Eine dritte Option ist die Ausbildung von Membrankanalproteinen, die jegliches Antibiotikummolekül, das in die Mikrobe eindringt, sofort wieder nach außen pumpen.
Resistenzmechanismen entstehen, weil wir Antibiotika massenhaft einsetzen – selbst in Situationen, in denen es aus medizinischer Sicht nicht notwendig ist. So gibt es immer noch Ärztinnen und Ärzte, die solche Medikamente bei Virusinfektionen (etwa gegen Erkältungen) verschreiben, obwohl sie gegen Viren nicht wirken. In einigen Ländern kann man Antibiotika im Supermarkt kaufen und nach Belieben einnehmen. Mancherorts setzen Mediziner antibiotische Wirkstoffe in großem Stil vorbeugend ein, das heißt, ohne dass bakterielle Infektionen vorliegen – nur, um im Nachhinein nicht wegen irgendwelcher Behandlungsfehler verklagt zu werden.
Weiterhin kommen Antibiotika in der Landwirtschaft zur Anwendung. Hier dienen sie zur Krankheitsprophylaxe in der Massenviehhaltung, die für die Tiere mit starkem Stress und erhöhtem Infektionsrisiko einhergeht. Darüber hinaus werden sie in einigen Ländern als Wachstumsförderer genutzt. Und das, obwohl jeglicher Antibiotikaeinsatz einen Selektionsdruck auf bakterielle Krankheitserreger ausübt, der die evolutionäre Entstehung von Resistenzmechanismen begünstigt. Wir bekommen es deshalb zunehmend mit multiplen Resistenzen zu tun, sprich mit Krankheitskeimen, die unempfindlich gegenüber mehreren Wirkstoffen sind. Im schlimmsten Fall erweisen sich die Pathogene als resistent gegen alle verfügbaren Medikamente; die von ihnen verursachten Erkrankungen lassen sich dann kaum noch behandeln.
Multiresistente Killer
Die enorme Ausbreitung der Antibiotikaresistenzen und die damit einhergehenden klinischen Probleme bezeichnen Fachleute als Antibiotikakrise. Sie hat bereits alarmierende Ausmaße angenommen. Zu Beginn des Jahres 2022 erschien in der Fachzeitschrift »The Lancet« eine systematische Übersichtsarbeit zur Bedrohung durch arzneimittelresistente Bakterien. Die Studie der Antimicrobial Resistance Collaborators, eines Zusammenschlusses dutzender Forscherinnen und Forscher, griff auf umfangreiche Datensätze zurück, die im Jahr 2019 weltweit erhoben worden waren und Angaben zu diversen Krankheitserregern und Arzneimitteln enthielten. Deren Analyse belegt, dass rund um den Globus etwa fünf Millionen Sterbefälle jährlich im Zusammenhang mit multiresistenten Keimen stehen. Für ungefähr 1,3 Millionen davon identifizierte das Team die resistenten Bakterien als direkte Todesursache, bei den restlichen Fällen besteht zumindest eine enge Verbindung zwischen Infektion und Tod.
Wenn wir nichts gegen die Antibiotikakrise unternehmen, laufen wir Gefahr, in eine Zeit wie vor 100 Jahren zurückzufallen, als bakterielle Erkrankungen nicht ursächlich behandelbar und somit potenziell tödlich waren – und selbst einfache operative Eingriffe lebensbedrohliche Folgen haben konnten. Die Weltgesundheitsorganisation sowie zahlreiche nationale Gesundheitsinstitutionen haben daher umfangreiche Maßnahmen ergriffen, um die Krise einzudämmen. Erstaunlicherweise finden evolutionäre Prozesse dabei so gut wie keine Berücksichtigung. In der erwähnten »Lancet«-Publikation beispielsweise tauchen die Begriffe »evolution« oder »evolve« nicht auf. Und das stellt ein Problem dar.
Denn es ist ja gerade die Fähigkeit der Bakterien, sich evolutionär schnell weiterzuentwickeln und an neue Umgebungsbedingungen anzupassen, die Antibiotikaresistenzen so rasch verbreitet. Im Zuge ihrer Evolution haben es die Mikroben bisher noch immer geschafft, Resistenzen auszubilden – und zwar gegen sämtliche eingesetzten Arzneistoffe. Maßnahmen, um die Antibiotikakrise zu bewältigen, können deshalb nur dann nachhaltig wirken, wenn sie evolutionäre Prozesse berücksichtigen. Tun sie das nicht, laufen sie Gefahr, unbeabsichtigte Selektionsdrücke auszuüben und damit neue Resistenzmechanismen zu triggern. So können falsch zusammengestellte Antibiotikakombinationen zur explosionsartigen Vermehrung unempfindlicher Bakterien führen und damit das Gegenteil dessen bewirken, was sie erreichen sollen.
Meine Kollegen und ich fanden im Jahr 2013 heraus: Behandelt man E.-coli-Bakterien sowohl mit Erythromycin als auch Doxycyclin, begünstigt man die Evolution doppelt resistenter Mikroben. Gelingt es damit nicht, die Bakterien schnell auszulöschen, beginnen sich die resistenten Varianten nach kurzer Zeit zu vermehren und stellen nach einigen Tagen eine größere Population, als wenn man nur ein Antibiotikum verabreicht.
Mit dem richtigen Behandlungsregime lässt sich das verhindern, wie wir 2018 aufzeigten. Dabei haben wir die Resistenzevolution in mehr als 1600 Experimenten mit rund 40 verschiedenen Antibiotikakombinationen beobachtet. Unsere systematische Untersuchung ergab, dass antimikrobielle Arzneistoffe, die sich gegenseitig in ihrem Effekt auf die Bakterien verstärken – Fachleute bezeichnen sie als synergistische Kombinationen –, zu einer deutlich höheren Aussterberate unter den krank machenden Mikroben führte. Die Anpassungsfähigkeit der Keime war zusätzlich eingeschränkt, wenn die verabreichten Antibiotika eine so genannte kollaterale Sensitivität (siehe weiter unten) bewirkten. Anschaulich ausgedrückt, werden die Bakterien dabei in einen evolutionären Konflikt hineinmanövriert, dem sie nicht entrinnen können, was zu ihrem Untergang führt. Der Schlüssel, um bakterielle Infektionen erfolgreich zu behandeln, lautet demnach, einen Therapieplan zu entwickeln, der evolutionäre Mechanismen berücksichtigt.
Was genau ist Evolution? Evolution tritt auf, wenn sich die genetische Zusammensetzung einer Population über die Zeit verändert. Es muss dabei eine Variation in vererbbaren Merkmalen wie auch in der Fortpflanzung auftreten. Führen diese Veränderungen unter bestimmten Umweltbedingungen direkt zu einem höheren Fortpflanzungserfolg, dann verbessern sie die Anpassung an diese Bedingungen und sind adaptiv, wie es in der Fachsprache heißt. Wirken sie sich nicht direkt auf die Vermehrung aus, sind sie neutral. Bei nachteiligen Konsequenzen gelten sie als maladaptiv. Mittlerweile kennen wir viele Faktoren, die evolutionäre Prozesse beeinflussen.
Von Generation zu Generation
Eine wichtige Methode, um solche Vorgänge zu untersuchen, sind so genannte Evolutionsexperimente. Sie finden in einer kontrollierten Laborumgebung und mit kurzlebigen Versuchsorganismen statt, an denen sich Adaptionsprozesse zeitnah verfolgen lassen. Indem man die Organismen unterschiedlichen Bedingungen aussetzt und beobachtet, wie sie darauf reagieren, kann man herausfinden, welche Faktoren die Evolution prägen.
Forscher und Forscherinnen haben in solchen Experimenten wiederholt untersucht, wie sich Antibiotikatherapien auf die Resistenzevolution bakterieller Krankheitserreger auswirken. Typischerweise teilen sie dabei eine Bakterienpopulation – etwa der Spezies Pseudomonas aeruginosa – in mehrere Gruppen auf, indem sie diese in separate Kulturgefäße geben. Jede dieser Gruppen wird einem anderen Behandlungsregime ausgesetzt. Je nachdem, wie gut die Mikroben damit zurechtkommen, vermehren sie sich besser oder schlechter. Die Wissenschaftler beobachten das mitunter tage- oder wochenlang, messen immer wieder das Zellwachstum, entnehmen in regelmäßigen Abständen Bakterien aus den Kulturen und untersuchen sie, darunter eben auch auf Resistenzen.
Derlei Versuche haben zahlreiche wichtige Ansätze geliefert, wie sich Arzneistoff-Unempfindlichkeiten vermeiden lassen. Zwei davon stechen heraus: das schnelle Wechseln der verabreichten Antibiotika und die kollaterale Sensitivität.
Organismen passen sich evolutionär umso besser an eine bestimmte Umwelt an, je stabiler und beständiger diese ist. Denn dann treten nach und nach immer mehr adaptive Modifikationen auf und verbreiten sich in der Population. Ändern sich die Umgebungsbedingungen hingegen ständig, können günstige Veränderungen jederzeit zu ungünstigen werden und umgekehrt, was eine nachhaltige Adaption unmöglich macht. Eine »sequenzielle Antibiotikatherapie«, bei der die verabreichten Wirkstoffe in rascher Folge wechseln, sollte krank machende Bakterien deshalb daran hindern, sich mittels Resistenzbildung anzupassen.
Mein Team und ich haben in mehreren Laborstudien demonstriert, dass dieser Ansatz funktioniert. Bei potenziellen Krankheitserregern wie Pseudomonas aeruginosa, Escherichia coli und Staphylococcus aureus lässt sich durch schnelle Antibiotikawechsel zumindest anfangs die Resistenzbildung verlangsamen; zudem führen solche Behandlungen häufiger zum Aussterben der Bakterienpopulation. Bisher ist das jedoch nur mit Hilfe von Laborexperimenten getestet worden und nicht im klinischen Umfeld. Entsprechende Untersuchungen werden hoffentlich bald folgen.
Als besonders viel versprechendes Prinzip einer nachhaltigen Antibiotikatherapie haben sich evolutionäre »Trade-offs« erwiesen. Trade-offs sind Zielkonflikte: Sie treten auf, wenn die evolutionäre Entstehung oder Verstärkung eines bestimmten Merkmals dazu führt, dass ein anderes verkümmert. Dazu kommt es beispielsweise, wenn jedes dieser Merkmale kostspielig ist und nicht genügend Ressourcen für beide zur Verfügung stehen. Oder wenn die Ausbildung von Eigenschaft A eine molekulare Veränderung voraussetzt, unter der Eigenschaft B leidet. Im Hinblick auf verbesserte Antibiotikatherapien ruhen große Hoffnungen auf einer speziellen Form evolutionärer Trade-offs, der kollateralen Sensitivität.
Von kollateraler Sensitivität sprechen wir, wenn verstärkte Resistenz gegenüber einem Antibiotikum zur Folge hat, empfindlicher gegen ein anderes zu werden. Das Phänomen haben Waclaw Szybalski und Vernon Bryson vom Biological Laboratory in Cold Spring Harbor, USA, schon im Jahr 1952 beschrieben. Es geriet aber wieder in Vergessenheit und wurde erst 2013 erneut entdeckt. Seitdem haben Forscherinnen und Forscher es bei diversen bakteriellen Krankheitserregern nachgewiesen; mein Team und ich belegten es im Jahr 2017 für die Spezies Pseudomonas aeruginosa.
Kollaterale Sensitivität ist bei Mikroorganismen weit verbreitet, kann jedoch unterschiedliche Antibiotika beziehungsweise Kombinationen davon betreffen. Deshalb müssen Fachleute diesen Trade-off-Effekt für jede Erregerpopulation einzeln untersuchen und charakterisieren. Der Aufwand lohnt sich aber, weil man die Bakterien damit in eine evolutionäre Sackgasse manövrieren kann. Zuerst mit Wirkstoff A behandelt, evolvieren sie eine Resistenz dagegen und werden dadurch empfindlicher gegenüber Stoff B, den sie im Anschluss verabreicht bekommen. Meine Kollegen und ich haben für Pseudomonas aeruginosa gezeigt: Eine Resistenzevolution gegen das Fluorchinolon-Antibiotikum Ciprofloxacin zieht eine erhöhte Anfälligkeit gegenüber Aminoglykosid-Antibiotika nach sich. Die medikamentöse Behandlung von Ciprofloxacin auf Aminoglykoside umzustellen, kann die Bakterien deshalb nachhaltig dezimieren. Verallgemeinert ausgedrückt: Kollaterale Sensitivität verstärkt die Wirkung einer sequenziellen Antibiotikatherapie – vorausgesetzt, man behandelt mit den richtigen Medikamenten in der richtigen Reihenfolge. Der Wechsel des Arzneistoffs muss hierfür nicht notwendigerweise schnell erfolgen. Die Methode funktioniert auch, wenn man beide verwendeten Antibiotika zeitgleich verabreicht.
Laborexperimente verschiedener Forschungsgruppen haben bereits umfangreiche Daten dazu geliefert, wie sich die kollaterale Sensitivität bestmöglich einsetzen lässt, um Infektionen zu behandeln und gleichzeitig die Resistenzbildung zu minimieren. Eine spannende Frage lautet, ob und wie das auf die ärztliche Behandlung menschlicher Patienten übertragbar ist.
Festzuhalten bleibt: Ohne evolutionäre Prozesse zu berücksichtigen, werden wir die Antibiotikakrise nicht nachhaltig bewältigen. Die bisherigen Laborversuche haben viele Erkenntnisse dazu geliefert, wie sich solches Wissen für eine verbesserte Antibiotikabehandlung nutzen lässt. Besonders wichtig ist die Entdeckung, dass eine bessere Therapie mit bereits vorhandenen Antibiotika erreicht werden kann. Neue Wirkstoffe zu entwickeln, wie von der WHO und vielen nationalen Gesundheitsinstitutionen gefordert, scheint somit nicht immer zwangsläufig vonnöten. Eine gute Nachricht, denn neue Antibiotika auf den Markt zu bringen, ist teuer, Zeit raubend und oft leider von geringem Erfolg gekrönt, da die Mikroben binnen kurzer Zeit erneut Resistenzen dagegen ausprägen, wie die Erfahrung lehrt.
Neben den genannten Ansätzen einer evolutionsbasierten Medizin entwickeln Fachleute weitere Behandlungskonzepte, bei denen sie antimikrobielle Proteinfragmente, Bakterien zerstörende Viren oder Mikroben mit vorteilhaften Eigenschaften einsetzen. All diese Methoden können den Gebrauch von Antibiotika reduzieren und somit den Selektionsdruck auf Krankheitskeime mindern, Resistenzen auszubilden.
Und wie ist es mit Ann-Kathrins schmerzendem Ohrenleiden weitergegangen? Die Infektion ließ sich glücklicherweise heilen, indem die Patientin ein Kombinationspräparat aus den antibiotischen Arzneistoffen Polymyxin B, Neomycin und Gramicidin erhielt. Das drängte den Keim schließlich zurück. Möglicherweise erlag er dabei der kollateralen Sensitivität: Ann-Kathrin war zuvor ja mit Ciprofloxacin behandelt worden, und eine Resistenz dagegen geht bei Pseudomonas aeruginosa meist mit einer erhöhten kollateralen Sensitivität gegenüber Aminoglykosid-Antibiotika einher, zu denen das im Präparat enthaltene Neomycin gehört.
Über das KielSCN
Das Kieler Netzwerk für Wissenschaftskommunikation (KielSCN) entwickelt neue Ansätze für die Kommunikation von wissenschaftlichen Inhalten. Dabei liegt der Fokus auf Visualisierungen von Informationen und deren Wahrnehmung. Was macht hochwertige Visualisierungen in der Wissenschaftskommunikation aus und wie werden diese entwickelt? Wie nehmen unterschiedliche Zielgruppen Visualisierungen wahr und wie können Gestaltungsmerkmale das Erreichen von Zielen in der Wissenschaftskommunikation unterstützen? Was benötigen Forschende, Studierende und Jugendliche, um wissenschaftliche Erkenntnisse auch mit visuellen Mitteln effektiv zu kommunizieren? Diesen Fragen widmet sich das interdisziplinäre KielSCN-Team in verschiedenen Forschungsvorhaben und Projekten.
Weitere Informationen finden Sie hier: www.kielscn.de
Schreiben Sie uns!
Beitrag schreiben