Lexikon der Chemie: Hybridisierung
Hybridisierung, eine Mischung (Linearkombination) von Atomorbitalen eines Atoms zu Hybridorbitalen, die aufgrund der starken Richtungsabhängigkeit ihres Bindungsvermögens besonders zur Darstellung lokalisierter Bindungen geeignet sind. Das Konzept der H. geht auf L. Pauling zurück und hat sich besonders bei der Beschreibung der Bindungsverhältnisse von Kohlenstoffverbindungen sowie Komplexverbindungen der Übergangsmetalle bewährt. Um die Vierbindigkeit des Kohlenstoffatoms, z. B. im Methan CH4, erklären zu können, muß zunächst ein Elektron aus dem doppelt besetzten 2s-Orbital in das leere 2p-Orbital angeregt werden. Betrachtet man die Valenzelektronen, so entsteht aus dem Grundzustand mit der Konfiguration 2s2 2p2 der energetisch höhere Zustand 2s1 2p3. Die dazu erforderliche Energie wird als Promotionsenergie bezeichnet. Die Linearkombination des 2s-Orbitals mit den drei 2p-Orbitalen führt zu vier energetisch gleichwertigen sp3-Hybridorbitalen, die jeweils mit einem Elektron besetzt sind. Dieser Zustand, der Valenzzustand, wird durch (sp3)4 symbolisiert. Die H. selbst stellt somit keinen physikalischen Vorgang, sondern nur eine Transformation von Atomorbitalen dar, die nicht mit einer Änderung der Gesamtenergie verbunden ist (Abb. 1). Die sp3-Hybridorbitale weisen nach den Ecken eines Tetraeders und bilden einen Winkel von 109° 28'. Ihre Überlappung z. B. mit 1s-Orbitalen von Wasserstoffatomen führt zur Bildung der vier C-H-Bindungen im Methanmolekül. Die zur Realisierung der Vierbindigkeit des Kohlenstoffatoms erforderliche Promotionsenergie wird durch die bei der Bindungsbildung freiwerdende Energie überkompensiert. In ähnlicher Weise führt die Linearkombination von einem s- und einem p-Orbital des gleichen Atoms zu zwei sp-Hybridorbitalen, die einen Winkel von 180° bilden. Unter Annahme einer sp-Hybridisierung läßt sich z. B. die lineare Struktur des BeH2-Moleküls erklären. Wird ein s- mit zwei p-Orbitalen des gleichen Atoms kombiniert, resultieren drei sp2-Hybridorbitale. Sie weisen nach den Ecken eines gleichseitigen Dreiecks und schließen einen Winkel von 120° ein. sp2-Hybridorbitale sind daher z. B. zur Beschreibung der Bindungsverhältnisse des trigonal eben gebauten BF3-Moleküls geeignet. Die räumliche Gestalt der sp-, sp2- und sp3-Hybridorbitale zeigt Abb. 2. Nach dem Prinzip der maximalen Überlappung (Molekülorbitaltheorie) gibt die Orientierung der Hybridorbitale die bevorzugte Richtung der Valenz an. Mit Hilfe von sp- und sp2-Hybridorbitalen kann auch die Struktur von Molekülen mit Mehrfachbindungen, z. B. Ethin und Ethen, durch lokalisierte Bindungen erklärt werden. Die H. ist nicht auf s- und p-Orbitale beschränkt. Bei den Elementen der dritten und höherer Perioden können auch D-Orbitale einbezogen werden. Für die Hybridorbitaltypen unter Beteiligung von D-Orbitalen resultieren die folgenden geometrischen Anordnungen: sp2d quadratisch planar, sp3d trigonal eben oder quadratisch pyramidal, sp3d2 oktaedrisch.
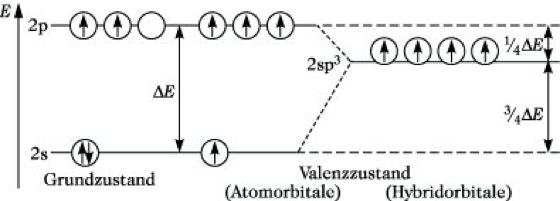
Hybridisierung. Abb. 1: sp3-Hybridisierung am Kohlenstoffatom.
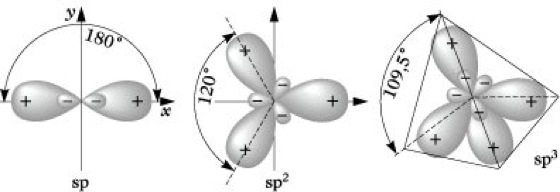
Hybridisierung. Abb. 2: sp-, sp2-, sp3-Hybridorbitale.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.