Lexikon der Geowissenschaften: Diadochie
Diadochie, die Ersetzbarkeit oder Substitution der Elemente in den Kristallstrukturen bezeichnet man als Diadochie ( Abb. ). Voraussetzung für eine solche diadoche Vertretbarkeit sind ähnliche Atom- bzw. Ionenradien und ein ähnlicher Bindungscharakter bei Wahrung des elektrostatischen Gleichgewichtes. Formelmäßig werden die sich vertretenden Ionen in Klammern gesetzt und durch Kommas voneinander getrennt. In der Formel der Mischkristalle (Ba,Sr)SO4 bedeutet das, daß sich Ba2+-Ionen mit einem Radius von 1,34 Å und Sr2+-lonen mit einem Radius von 1,12 Å gegenseitig vertreten können. Die beiden reinen Endglieder dieser Mischkristallreihe sind Baryt (BaSO4) und Cölestin (SrSO4). Bei Größenunterschieden der sich vertretenden Gitterbausteine von mehr als 15% ist eine vollständige Mischbarkeit bei Raumtemperatur i.a. nicht mehr gegeben. Werden in einem Kristallgitter Bausteine des Kristalls A durch Bausteine des Kristalls B ersetzt oder substituiert, bezeichnet man dies als Mischkristallbildung durch einfache Substitution. Die einzelnen Bausteine sind dabei statistisch regellos über das ganze Gitter verteilt, ein typisches Beispiel ist der Ersatz von Mg2+ durch Fe2+ im Olivin (Mg,Fe)2SiO4.
Findet dagegen Diadochie zwischen verschieden geladenen Ionenarten bei Wahrung der Ladungsneutralität statt, bezeichnet man dies als gekoppelte Substitution. Typisches Beispiel dafür ist die Diadochie zahlreicher gesteinsbildend auftretender Silicate, z.B. bei den Plagioklasen, wo Na+ und Si4+ durch Ca2+ und A13+ ersetzt werden. Mischkristallbildung durch Substitution, bei der alle gleichwertigen Gitterplätze wieder vollständig besetzt werden, ist sowohl bei isotypen als auch bei homöotypen und heterotypen Kristallarten möglich. Ist bei der Mischkristallbildung die Anzahl der besetzten gleichwertigen Gitterplätze größer als in der reinen Phase, bezeichnet man dies als Additionssubstitution. Dabei werden zusätzliche Gitterbausteine in die Lücken des reinen Ausgangsgitters eingelagert. Solche Einlagerungsstrukturen spielen eine große Rolle bei den Metallen, insbesondere beim Stahl, wo zusätzlich Cr-, Ni-, Mo-, W-, Co-, V-, Ti- und C-Atome in das Fe-Gitter eingelagert werden und dadurch die jeweils gewünschten Qualitätseigenschaften hervorrufen. Unter den Erzmineralen bilden Pyrit und Arsenkies Einlagerungsmischkristalle mit Gold, und auch die H2O-Moleküle bei den Hydraten sind häufig als Koordinationswasser an bestimmte Gitterplätze gebunden. Sind die Wassermoleküle dagegen statistisch auf vorhandene Gitterhohlräume verteilt, wie das bei den Zeolithen der Fall ist, bezeichnet man es als Strukturwasser oder zeolithisches Wasser (Zeolithwasser). Dieses eingelagerte Wasser kann den Zeolithen wieder vollständig entzogen werden, ohne daß das Gitter dabei zusammenbricht, so daß in diese Hohlräume dann andere Moleküle, wie z.B. Alkohol, eingelagert werden können.
Auf Einlagerungsmischkristalle sind auch die Gitterexpansionen und Quellungen der Tonminerale zurückzuführen. So können sich beim Montmorillonit Wasser- oder organische Moleküle, wie Hydrazin oder Glykol, zwischen die Silicatschichten einlagern und die Gitterabstände von 8 auf über 20 Å aufweiten. Diese Gitterquellung der montmorillonitischen Tone ist der Grund für ihre vielseitige Verwendung in der chemischen Technologie, z.B. als Adsorptionsmassen, sowie für ihre bodenphysikalischen Eigenschaften. Wenn die Anzahl der besetzten gleichwertigen Gitterplätze im Vergleich zur reinen Phase kleiner ist, spricht man von Subtraktionssubstitution. Ein Beispiel hierfür ist die Mischkristallbildung zwischen Nephelin (NaAlSiO4) und Quarz (SiO2). Diese Mischkristalle bilden ein gemeinsames Gitter aus Sauerstofftetraedern, deren Mitten beim Quarz von Si-Ionen, beim Nephelin jedoch zur Hälfte von Si- und Al-Ionen besetzt sind. Das Schema dieser Subtraktionssubstitution wird verständlich, wenn man anstatt SiO2 SiSiO4 schreibt. Tritt SiSiO4 zum Teil in das NaAlSiO4-Gitter ein, so bleibt ein Teil der im Nephelingitter von Na besetzten Plätze frei, da ja ein Valenzausgleich stattfinden muß. Additionssubstitution und Subtraktionssubstitution sind bei homöotypen und bei heterotypen Kristallarten möglich. Schließlich gibt es bei heterotypen Kristallarten noch eine weitere Art von Mischkristallbildung, nämlich durch Divisionssubstitution. Hierbei wird eine stöchiometrisch bedingte Anzahl von Bausteinen auf eine wesentlich größere Anzahl von vorhandenen Gitterplätzen verteilt.
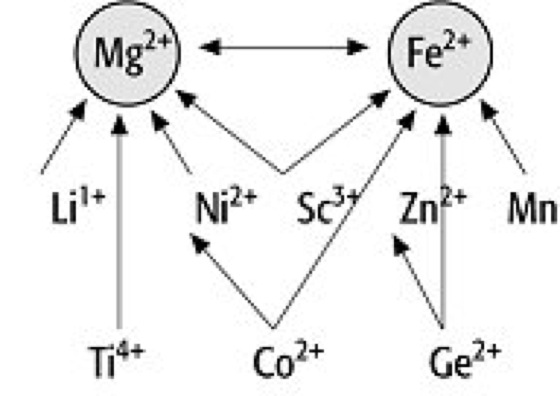
Die Diadochie spielt bei der Mineralbildung eine außerordentlich wichtige Rolle, da die Kristallisationsvorgänge in der Natur nie in reinen Systemen stattfinden, sondern fast alle Elemente des Periodensystems bei der Mineralbildung zur Verfügung stehen und entsprechend den Bausteinverhältnissen vielfach auch in die Mineralgitter eingebaut werden. Neben den Hauptelementen, die in den Formeln genannt sind, treten in den Mineralen daher stets noch eine Reihe weiterer Elemente auf, die in Spuren, z.T. aber auch in beträchtlichen Gehalten (bis 1%) vorhanden sind, in der Formel aber selten angegeben werden. Ihr Auftreten und ihre Verteilung in den Mineralgittern kann wertvolle Aufschlüsse über die Bildungsbedingungen der Minerale und über die Lagerstättengenese geben. Oft sind sog. Spurenelemente in beträchtlichen Gehalten in den Mineralen vorhanden, ohne daß sie dort isoliert werden können. Sie werden oft erst mit Hilfe der Röntgenfluoreszenzspektralanalyse (RFA) oder mit anderen spektroskopischen Methoden bestimmt. Der Grund liegt v.a. in dem sehr ähnlichen Verhalten der chemischen Reaktionen der sich im Gitter gegenseitig vertretenden Elemente. Man bezeichnet diese Erscheinung als isovalente Diadochie, auch als Tarnung oder Camouflage. So wurde z.B. das Element Hafnium, obwohl es in manchen Zirkonmineralen mit bis zu 3 Gew.-% vertreten ist, erst 1922 von v. Hevesey entdeckt. Typische Beispiele für Camouflage sind neben Zirkon, wo Hf4+ mit einem Ionenradius von 0,87 Å sich hinter Zr4+ mit einem Radius von 0,86 Å tarnt, die Mineralgruppe der Olivine, bei denen sich Ni2+ (0,78 Å) hinter Mg2+ (0,78 Å) tarnt, die Aluminiumsilicate, bei denen sich Gallium Ga3+ (0,62 Å) hinter Al3+ (0,57 Å) tarnt und die Silicate mit Quarz, wo sich das seltene Element Germanium Ge4+ (0,44 Å) hinter dem Si4+ (0,39 Å) tarnt.
Grundsätzlich haben die bei der Tarnung sich gegenseitig vertretenden Elemente eine gleiche Ladung und ähnliche Radien. Andererseits können die sich vertretenden Elemente aber auch eine unterschiedliche Ladung aufweisen, die Radien müssen jedoch stets ähnlich oder gleich sein. So finden sich in Calciummineralen, z.B. beim Fluorit CaF, anstelle der Ca2+-Ionen die seltenen Erden Yttrium Y3+, Cer Ce3+ oder Thorium Th4+ und in den Silicaten Beryllium Be2+ anstelle von Silicium Si4+. Viele Magnesiumsilicate enthalten Scandium Sc3+ statt Mg2+. Hier sind die Si4+-Bausteine in einem geringen Maße durch AI3+ ersetzt, so daß Sc3+ an die Stelle von Mg2+ treten kann, wodurch wieder Valenzausgleich eintritt. Diese Erscheinung bezeichnet man als heterovalente Diadochie oder als Abfangen. So wird im Monazit CePO4 Thorium Th4+ mit einem Radius von 1,10 Å von Ce3+ (1,18 Å) abgefangen. Ebenso Niob Nb5+ mit einem Radius von 0,69 Å von Ti4+ (0,64 Å) in den Titanmineralen. Da die Ionenradien von Kalium K+ (1,33 Å) und Barium Ba2+ (1,35 Å) sehr ähnlich sind, wird Barium vom Kalium in den Feldspäten abgefangen und findet sich daher stets und regional weit verbreitet in den Kalifeldspäten der magmatischen Gesteine.
Ionengröße der Kristallbausteine, Mischkristallbildung und Diadochie sind außerordentlich wichtige geochemische Faktoren. Die Verteilung der Minerale und ihrer Lagerstätten in der Erdkruste und an der Erdoberfläche sind ganz wesentlich auf diese kristallchemischen Ursachen zurückzuführen. So bilden sich bereits entsprechend ihrer Ionengrößen die Kristallgitter der Minerale bei Beginn des Kristallisationsprozesses magmatischer Schmelzen aus den vorhandenen kommensurablen Bausteinen. Elemente mit außergewöhnlichen Ionenradien, wie z.B. Beryllium, Bor oder Uran, reichern sich dagegen in den Restlösungen an, aus denen sie sich schließlich bei tieferen Temperaturen z.T. als selbständige Minerale auskristallisieren und nur deshalb in entsprechenden Lagerstätten konzentriert vorliegen und gewonnen werden können. [GST]







Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.