Bindungstheorie: Vielseitige Chemie mit brennbarer Luft
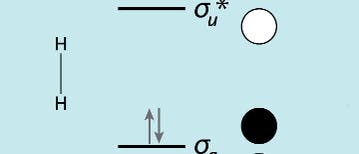
Meine erste Begegnung mit molekularem Wasserstoff (H2) war typisch für einen Jungen im Zeitalter der Chemiebaukästen. Der meinige enthielt etwas Zinkpulver, aber keine Säuren. Die sollte man laut Gebrauchsanleitung selbst aus anderen Chemikalien erzeugen – Salzsäure (HCl) etwa aus Natriumhydrogensulfat (NaHSO4) und Ammoniumchlorid (NH4Cl). Kleinere Mengen seien aber auch in der Apotheke zu haben. Tatsächlich bekam ich dort das Gewünschte, indem ich artig im besten mir zu Gebote stehenden Englisch – schließlich war ich erst ein Jahr zuvor aus Europa nach Brooklyn gekommen – danach fragte. Ich schüttete etwas von der Säure auf das Zink in einem Reagenzglas, beobachtete die aufsteigenden Bläschen, hielt mit leicht zittrigen Händen ein brennendes Streichholz hin und hörte mit EntzÜcken das charakteristische "Plopp" der Knallgasreaktion.
Als Nächstes begegnete ich der "brennbaren Luft" – so die Bezeichnung ihres Entdeckers Henry Cavendish (1731 – 1810) – bei einem Elektrolyseexperiment in der High School. Wir leiteten elektrischen Strom durch Wasser mit etwas gelöstem Kochsalz und fingen die Gase, die an den beiden Elektroden ausperlten, in umgestülpten Reagenzgläsern auf. Deren Inhalt verschaffte uns anschließend kleine pyrotechnische Freuden, indem wir ein frisch ausgeblasenes Streichholz hineinhielten. In einem Fall hörten wir das schon bekannte "Plopp" und im anderen loderte die erloschene Flamme zischend wieder auf.
Primo Levi beschreibt in seinem wunderbaren Buch "Das periodische System" dasselbe Experiment, das in seinem Fall allerdings etwas dramatischer verlief: ...
Schreiben Sie uns!
Beitrag schreiben