Lexikon der Geowissenschaften: Stereoisomerie
Stereoisomerie, Stereoisomere sind Isomere (Isomerie), die sich bei gleicher Konstitution nur in der Anordnung der Atome und Atomgruppen im Raum unterscheiden. Die Stereoisomerie wird folgendermaßen unterteilt:
1) Konformationsisomerie: Konformationsisomere (Konformere, Rotationsisomere, Rotamere) sind Stereoisomere, die sich bei gleicher räumlicher Anordnung von Atomen und Atomgruppen nur durch Rotation um C–C-Einfachbindungen voneinander unterscheiden. Sie können nur isoliert werden, wenn die Rotation um die betrachtete formale Einfachbindung verhindert ist (sterische Hinderung).
2) Konfigurationsisomerie:Konfigurationsisomere sind Stereoisomere, die sich in der räumlichen Anordnung von Atomen und Atomgruppen unterscheiden, ohne Berücksichtigung von Orientierungen, die nur durch Rotation um Einfachbindungen voneinander abweichen. Die meisten Konfigurationsisomere können im Unterschied zu den Konformationsisomeren isoliert werden. Fast alle durch Biosynthese hergestellten Naturstoffe, z.B. Kohlenhydrate, Steroide und Alkaloide, sind Konfigurationsisomere.
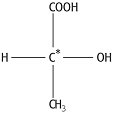
a) Enantiomerie:Enantiomere sind Konfigurationsisomere, die sich wie Bild und Spiegelbild verhalten. Diese Eigenschaft wird auch als Chiralität bezeichnet. Enantiomere zeigen unabhängig vom Aggregatzustand optische Aktivität, d.h., sie drehen die Ebene des linear-polarisierten Lichtes beim Durchgang durch sie, und zwar um den gleichen Betrag, aber im entgegengesetzten Sinn. Die rechtsdrehende Form wird durch ein dem Namen vorangestelltes (+), die linksdrehende durch ein (-) gekennzeichnet. Äquimolekulare Gemische zweier Enantiomere einer Verbindung werden als Racemate bezeichnet. Die überwiegende Mehrzahl aller optisch aktiven, also chiralen Verbindungen enthält ein asymmetrisches Kohlenstoffatom, d.h. ein Kohlenstoffatom mit vier unterschiedlichen Substituenten, als Chiralitätszentrum. In Strukturformeln werden asymmetrische Kohlenstoffatome oft mit einem Stern gekennzeichnet ( Abb. 1). Besitzt ein Molekül mehr als eines dieser asymmetrischen Zentren, können Diastereomere auftreten.
b) Diastereomerie:Diastereomere sind alle Konfigurationsisomere, die nicht Enantiomere sind. Sie treten bei Verbindungen mit mehreren Chiralitätselementen auf. Diejenigen Verbindungen, die sich in der Konfiguration aller asymmetrischen Kohlenstoffatome unterscheiden, sind Enantiomere. Alle anderen, die mindestens in der Konfiguration eines asymmetrischen Kohlenstoffatoms gleich sind und sich mindestens in der Konfiguration an einem asymmetrischen Kohlenstoffatom unterscheiden, sind Diastereomere. Epimere sind Diastereomere bei Verbindungen mit mehreren Chiralitätszentren, die sich nur in der Konfiguration eines dieser asymmetrischen Kohlenstoffatome unterscheiden. Epimerisierung ist die Konfigurationsumkehr nur eines von mehreren asymmetrischen Kohlenstoffatomen. Diastereomere haben unterschiedliche chemische und physikalische Eigenschaften; sie lassen sich demzufolge durch Destillation, Kristallisation oder chromatographische Trennverfahren (analytische Methoden) voneinander trennen.
Die Konfigurationsbezeichnung nach der Cahn-Ingold-Prelog-Konvention (CIP-Konvention) ist eindeutig und für alle chiralen Verbindungen anwendbar. Zunächst werden die Liganden eines Chiralitätszentrums nach fallenden Ordnungszahlen geordnet (Sequenz: a > b>c > d). Doppelbindungen werden zu zwei Einfachbindungen mit jeweils denselben Substituenten aufgelöst. Bei der Bestimmung der Konfiguration wird das chirale Kohlenstoffatom so betrachtet, daß die Bindung mit der niedrigsten Priorität (d), normalerweise ein Wasserstoffatom, vom Betrachter wegzeigt. Die übrigen drei Bindungen erscheinen nun in einer dreieckigen Anordnung. Wenn die Priorität der Gruppen in der Reihenfolge a b c im Uhrzeigersinn abnimmt, so liegt eine R-Konfiguration vor. Die S-Konfiguration liegt dementsprechend bei der Reihenfolge a b c entgegen dem Uhrzeigersinn vor ( Abb. 2). Die R/S-Notation bezeichnet asymmetrische Zentren außerhalb eines Ringsystems, wohingegen mit der α/β-Notation asymmetrische Zentren innerhalb des Ringsystems bezeichnet werden. α bezeichnet funktionelle Gruppen (oft die Wasserstoffatome) unterhalb der durch das Ringsystem aufgespannten Ebene, β die Position oberhalb der Ebene ( Abb. 3). Eine weitere Art der Darstellung der α- und β(H)-Konfiguration wird durch gefüllte oder ungefüllte Punkte ermöglicht ( Abb. 4). [SB]
Stereoisomerie 1: Kennzeichnung des asymmetrischen Kohlenstoffatoms.
Stereoisomerie 2: jeweils zwei Darstellungen der S- und der R-Konfiguration. Die oberen beiden Darstellung zeigen die S-Konfiguration, da die Reihenfolge der Substituenten a b c entgegen dem Uhrzeigersinn läuft, die beiden unteren Darstellungen die R-Konfiguration. Stereoisomerie 2:

Stereoisomerie 3: α/β-Konfigurationen am Beispiel des C27-Sterans. In der α-Konfiguration befindet sich das Wasserstoffatom unterhalb der vom Steran aufgespannten Ringebene.

Stereoisomerie 4: alternative Darstellungsmöglichkeit der α/β(H)-Konfigurationen mittels ausgefüllten (β) und nicht ausgefüllten (α) Punkten am Beispiel des C27-Sterans. Es sind nur die Konfigurationen der auch schon in der Abb. 3 behandelten Wasserstoffatome gekennzeichnet. Stereoisomerie 4:








Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.