Auf den Punkt genau
Kurzpulslaser, mit den Mitteln der stereotaktischen Neurochirurgie in Position gebracht, könnten Hirn- tumoren auf Mikrometer genau zerstören.
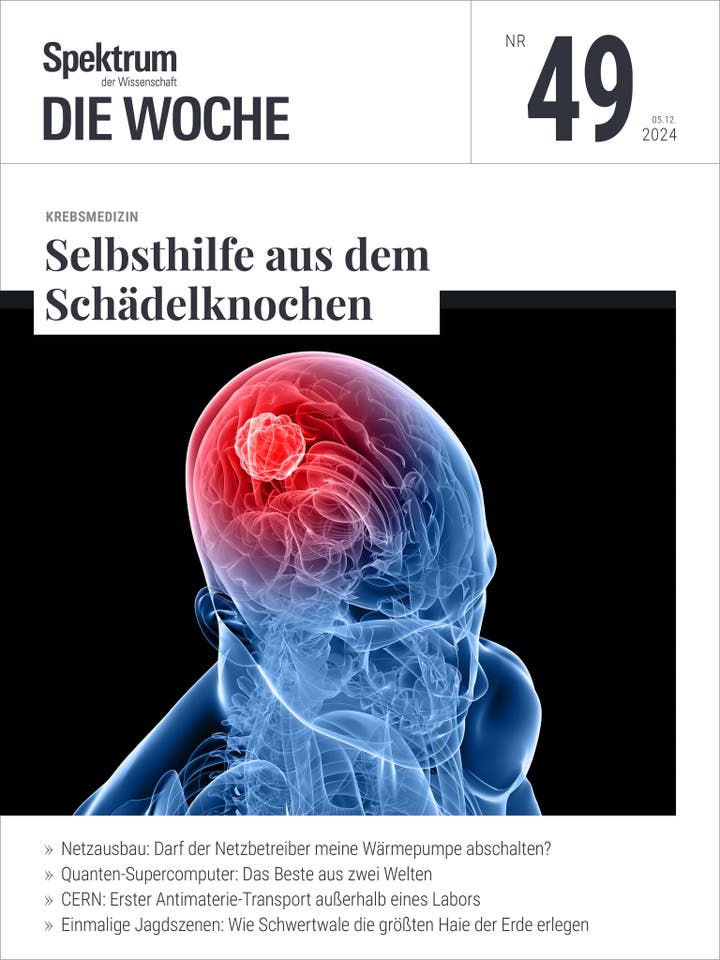
Hirntumoren wachsen oft langsam und bleiben lange unentdeckt. Manchmal äußern sie sich schließlich als rasendes Kopfweh oder gar als Ausfall des Sehsinnes. Insbesondere solche Geschwülste, die tief im Gehirn liegen oder in enger Nachbarschaft zu wichtigen Regionen, lassen sich kaum mit gutem Erfolg bekämpfen: Hier birgt ein operativer Eingriff verstärkt die Gefahr nachfolgender funktioneller Ausfälle oder Beeinträchtigungen, und die enge Nachbarschaft des wuchernden zum gesunden Gewebe schränkt auch die Behandlungsmöglichkeiten mit ionisierender Strahlung ein.
Seit einigen Jahren setzen Mediziner auch Laser als präzise Werkzeuge einer minimal invasiven Chirurgie ein. Sie leiten den Lichtstrahl durch Glasfasern oder Gelenkspiegelarme bis zum Operationsort, wo er das Gewebe sozusagen verkocht. Da sich Wärme aber weitgehend unkontrolliert ausbreitet, ist das Verfahren für die Neurochirurgie ungeeignet – Nebenwirkungen wie Lähmungen wären die mögliche Folge.
Mittlerweile nutzen Augenärzte aber sogenannte Kurzpuls-Laser, hauptsächlich zum Abtragen von Hornhaut. Damit lassen sich Zellen ohne Wärmeentwicklung zerstören: Im Brennpunkt des Lasers entsteht ein Plasma, das chemische Verbindungen spaltet; Experten sprechen von Photoablation.
Solche Geräte waren jedoch bisher zu komplex, zu groß und wartungsintensiv, vor allem auch zu leistungsschwach, um größeren Gewebsvolumina wie etwa einem Tumor beizukommen. Ein von der Europäischen Gemeinschaft mitfinanzierter Forschungsverbund entwickelt deshalb seit etwa drei Jahren ein auf dieser Technik basierendes neurochirurgisches System, das mittlerweile Prototypstadium erreicht hat.
An der Eidgenössischen Technischen Hochschule in Zürich entstehen dazu kompakte und leicht zu wartende Lasersysteme, sogenannte diodengepumpte Festkörper-Laser mit bis zu 10 Watt Leistungsdichte und Pulsdauern von Femto- bis Picosekunden (10-15 bis 10-12 Sekunden); die Ablation eines Kubikzentimeters Gewebevolumen dauert damit einige Minuten (Spektrum der Wissenschaften, Dossier 2, 1998, Laser in neuen Anwendungen).
Um den Strahl vor Ort zu bringen, baut das Institut für Angewandte Physik der Universität Heidelberg eine neuartige Sonde für die "Schlüsselloch-Chirurgie": Der Prototyp hat einen Außendurchmesser von 5,5 Millimetern und erfordert dementsprechend auch nur ein Bohrloch in der Schädeldecke von etwa 7 Millimetern. Die Zuführung des Laserstrahls in die Sonde erfolgt über einen Gelenkspiegelarm, da Glasfasern bei derartigen Leistungsdichten nicht in Frage kommen. Der Arm besteht aus fünf dünnen Röhren, die über vier Gelenke miteinander verbunden sind; in jedem schicken Spiegel den Strahl in die nächste Röhre. Ein Prisma am Ende lenkt ihn dann im rechten Winkel auf das umliegende Gewebe.
Der Tumor wird dann von innen heraus Schicht um Schicht abgetragen wie eine Zwiebel. Um das Volumen präzise zu erfassen, stehen vier Freiheitsgrade zur Verfügung: Rotieren des Strahls um die Sondenachse, Eindringen der Sonde in den Tumor, Fokussierung des Strahls auf unterschiedliche Entfernungen von der Sonde und schließlich Ein- beziehungsweise Ausschalten, um bei unregelmäßig geformter Geschwulst gesundes Gewebe zu schonen.
Abgelöste Zellen müssen aus dem Gehirn entfernt werden. Der entstehende Hohlraum füllt sich mit Gewebeflüssigkeit. Soll nicht die gesamte vorige Planung obsolet werden, darf sich die Form des Tumors dabei nicht ändern. Deshalb haben unsere Kollegen am Institut für Regelungstechnik der Universität Siegen eine in die Sonde integrierte Spül- und Absaugvorrichtung mit Druckregelung entwickelt.
Die optimale computerunterstützte Planung der Behandlung anhand von Gewebedaten, wie sie Computer- und Kernspintomograph liefern, ist ebenso unabdingbar wie die Überwachung des Operationsverlaufs mittels solcher bildgebender Verfahren. Diesen Part des Projekts übernimmt unsere Abteilung für Medizinische Physik am Deutschen Krebsforschungszentrum (DKFZ) in Heidelberg in Zusammenarbeit mit der Neurochirurgischen Klinik der Universität zu Köln; diese Arbeiten fördert die Deutsche Krebshilfe.
Methoden zur Berechnung der vom Laser eingebrachten Energie und deren Optimierung werden noch erarbeitet und in das Planungsprogramm STORM integriert. Das Akronym der DKFZ-Software steht für Stereotactical Treatment-Planning, Optimization, Resection and Monitoring Tool. Diese stereotaktische Operationstechnik wurde von den Ärzten Lars Leksell in Stockholm und Fritz Mundinger in Freiburg in den sechziger Jahren entwickelt. Man nutzt sie heute, um bei Operationen, Bestrahlungen und sogar Chemotherapien im Gehirn sehr präzise und lokal begrenzt zu arbeiten. Dazu wird ein sogenannter stereotaktischer Grundring aus Edelstahl oder Keramik an den Schädelknochen geschraubt. Er dient als festes Koordinatensystem und ist auf den Computertomogrammen zu sehen. Jeder Punkt in den verschiedenen Schnittbildern läßt sich deshalb genau lokalisieren. Der Grundring dient auch der präzisen Führung von Sonden.
Die Planung der Behandlung am Rechner soll – wie in der Strahlentherapie auch – in mehreren Schritten erfolgen. Zunächst wird der Arzt anhand einer dreidimensionalen Gesamtansicht der Anatomie und der Operationsinstrumente den Ort der Schädelöffnung und die Winkel der Sonde interaktiv in den Schichtbildern festlegen. Oberstes Gebot dabei ist, eine Verletzung von Hirnnerven, Gefäßen und sensiblen Arealen zu vermeiden.
Ergänzend besteht die Möglichkeit, das System automatisch nach optimalen Operationsparametern suchen zu lassen, wobei derzeit nur die Geometrie und Lage der Geschwulst berücksichtigt werden, künftig aber auch Blutgefäße und andere verbotene Bereiche. Der Optimierung liegen verschiedene mathematische Algorithmen zugrunde wie das simulated annealing (Spektrum der Wissenschaft, April 1988, S. 19) oder Evolutionsstrategien (Spektrum der Wissenschaft, Juli 1987, S. 104). Aus den so gefundenen Zugangswegen wählt der Operateur den auch aus medizinischer Sicht geeigneten aus.
Ob der gewählte Zugangsweg auch den optimalen Tumorabtrag bringen wird, zeigt dann die Dosisberechnung. Sie ermittelt, in welche Richtung wie lange und mit welcher Leistung der Laser strahlen muß, um die Geschwulst vollständig zu entfernen. Zuletzt berechnet das Computerprogramm die Koordinaten zur Einstellung des stereotaktischen Zielgerätes.
Alle Erfahrungen aus der konventionellen wie aus der Präzisionsstrahlentherapie zeigen allerdings, daß Theorie und Praxis differieren können. Deshalb ist eine Kontrolle des Operationsverlaufs mittels bildgebender Verfahren unumgänglich. Zur Zeit werden vom Verbund drei Möglichkeiten untersucht: Das Institut für Angewandte Physik hat ein konfokales Laser-Scanning-Mikroskop entwickelt, dessen Optik als Endoskop in die Sonde zu integrieren ist und den Operationsbereich mit höchster Ortsauflösung und Tiefenschärfe darstellt (bei diesem Mikroskop wird eine bestimmte Schicht des beobachteten Objekts Punkt für Punkt aufgenommen; vergleiche auch "Konfokale Mikroskopie" von Jeff W. Lichtman, Spektrum der Wissenschaft, Oktober 1994, S. 78).
Als zweite Möglichkeit der visuellen Kontrolle untersuchen wir am DKFZ den Einsatz eines 3D-Ultraschallkopfes, der in ein zusätzliches Bohrloch von maximal 1,5 Zentimeter Durchmesser eingebracht und dann auf die Hirnhaut aufgelegt werden soll. Ultraschallbilder ließen sich mit den CT- und MR-Daten vor der Operation sowie den endoskopischen Bildern vergleichen, um den Gewebeabtrag genau zu beurteilen.
Die wahrscheinlich genaueste, aber auch schwierigste und teuerste Variante schließlich bietet die Magnetresonanz-Tomographie. Die Durchführung der Operation in einem solchen System, also unter starken und ständig wechselnden Magnetfeldern, erfordert freilich spezielle Materialien für das stereotaktische Fixierungs- und Zielsystem wie auch für die Lasersonde; in elektrisch leitfähigen Werkstoffen würden sonst beispielsweise bildverfälschende elektrische Wirbelströme induziert. Dadurch stellen sich allerdings neue Probleme, denn die neuen Werkstoffe müssen auch sterilisierbar und gewebeverträglich sein. Für den Grundring eignen sich beispielsweise Keramiken. Das DKFZ, das Institut für Angewandte Physik und die Heidelberger Firma MRC Systems arbeiten gemeinsam an Lösungen; letztere ist aus dem Forschungsverbund hervorgegangen und wird die Zulassung des kompletten neurochirurgischen Lasersystems, Fertigung und Vertrieb übernehmen.
Derzeit erprobt die Neurochirurgische Klinik der Universität Leuven (Belgien) die Prototypen eines Ein-Watt-Kurzpuls-Lasersystems, die stereotaktische Sonde und die dazugehörigen Rechnersteuerungsprogramme im Tierexperiment. Die bisherigen Ergebnisse sind vielversprechend. So gelang es, Tumoren auf etwa 50 Mikrometer (tausendstel Millimeter) genau abzutragen, ohne umliegendes gesundes Gewebe zu schädigen.
Noch in diesem Jahr sollen die Planungsprogramme fertiggestellt, die Laserleistung verzehnfacht und die beschriebenen bildgebenden Verfahren integriert werden. Im Frühjahr 2000 will die Abteilung für Stereotaktische Neurochirurgie der Universität zu Köln die Sonde erstmals am Patienten einsetzen. Noch innerhalb der nächsten drei Jahre soll der klinische Routinebetrieb mit diesen Systemen weltweit möglich sein
Aus: Spektrum der Wissenschaft 11 / 1999, Seite 92
© Spektrum der Wissenschaft Verlagsgesellschaft mbH



Schreiben Sie uns!
Beitrag schreiben