STROMSPEICHER: Wie Lithiumakkus funktionieren
Voraussetzung für den Siegeszug tragbarer elektronischer Geräte seit den 1980er Jahren war die Entwicklung leistungsfähiger Batterien. Die damals üblichen Nickel-Cadmium- und Nickelmetallhydrid-Akkumulatoren waren für Handys oder Laptops zu schwer und sperrig und boten nicht genügend Speicherkapazität für einen längeren Betrieb. Den Durchbruch brachten schließlich Systeme auf Basis von metallischem Lithium. Sie erreichten die beachtliche Spannung von etwa drei Volt pro Zelle. Das erforderte allerdings den Einsatz einer organischen Flüssigkeit als Elektrolyt. Das in Nickel-Cadmium- oder Blei-Akkumulatoren verwendete Wasser hätte mit dem Lithium reagiert und sich bei der zum Laden nötigen hohen Spannung zersetzt (Elektrolyse zu Sauerstoff und Wasserstoff).
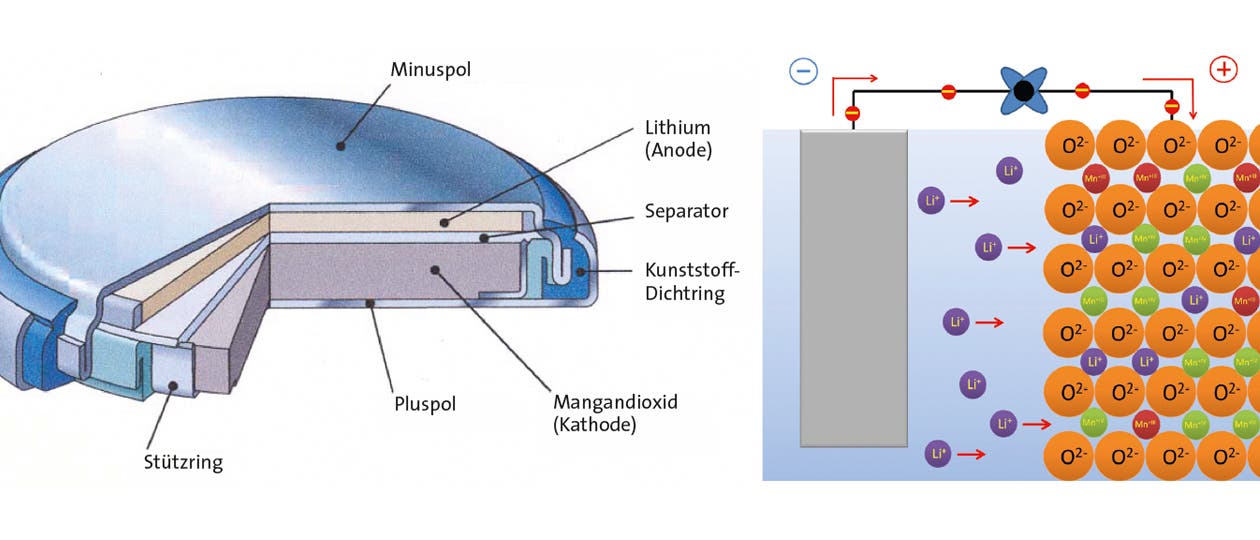
Lithiumbatterien kamen zunächst hauptsächlich als Knopfzellen auf den Markt (Bild unten). Darin dient metallisches Lithium als Anode (Minuspol). Die Kathode (der Pluspol) besteht aus Mangandioxid (MnO2) oder einem anderen Material, das Metallionen einlagern kann – ein als Interkalation bezeichneter Vorgang.
Beim Entladen löst sich die Lithiumanode auf. Die Lithiumatome geben jeweils ein Elektron an den Stromkreis ab und verwandeln sich in positiv geladene Ionen, die in die Elektrolytlösung übertreten und zur Kathode wandern. Dort zwängen sie sich in das MnO2-Gitter. Zum Ladungsausgleich nehmen die Manganatome aus dem Stromkreis eine analoge Menge an Elektronen auf und gehen dadurch vom vier- in den dreiwertigen Zustand über. ...
© Matthias Ducci und Marco Oetken
Ergänzende Informationen (PDF)
Genaue Versuchsbeschreibung und weitere Informationen zum Dual-carbon-Akkumulator und zum Lithium-Ionen-Power-Pack






Schreiben Sie uns!
Beitrag schreiben