Zellbiologie: Proteine ohne Struktur
Angesichts der Bedeutung der Proteine sollte man meinen, dass die Biologen längst geklärt hätten, wie diese Moleküle funktionieren und ihre räumliche Gestalt annehmen. Viele Wissenschaftler haben aber jahrzehntelang mit einem unvollständigen Modell gearbeitet. Sie hatten zwar erkannt, dass Proteine aus Aminosäuren bestehen, die wie Perlen auf einer Schnur aufgereiht sind. Jedoch waren sie überzeugt davon, dass ein Protein nur dann korrekt funktioniert, wenn die Aminosäurekette sich zu einer ganz bestimmten, starren Struktur faltet. Mittlerweile wird immer klarer, dass viele Proteine ihre biologischen Funktionen erfüllen, ohne sich jemals vollständig zu falten; andere wiederum tun das nur bei Bedarf. Tatsächlich ist wohl ein Drittel aller menschlichen Proteine "intrinsisch unstrukturiert" – das heißt, sie enthalten Regionen, die sich aus sich selbst heraus nicht falten.
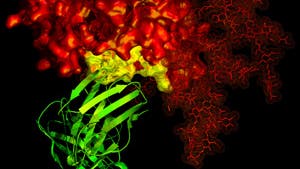
Selbstverständlich wissen die Biologen schon seit einiger Zeit, dass nicht alle Proteine starr sind. So haben sich die Polymerasen, die das Erbgutmolekül DNA kopieren oder es in RNA umschreiben, als komplizierte Nanomaschinen mit vielen beweglichen Teilen erwiesen. Aber diese Proteine werden oft als Konstrukte aus starren Segmenten und gelenkigen Verbindungsstücken angesehen, ähnlich einem Klappstuhl. Intrinsisch unstrukturierte Proteine muss man sich jedoch anders vorstellen, eher wie halbweiche Spagetti, die fortwährend in einem Topf kochenden Wassers herumwabern...






Schreiben Sie uns!
Beitrag schreiben