Proteinstruktur: Eiweiß zeigt innere Stärke
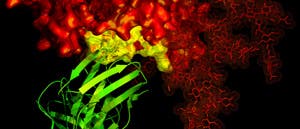
© NIAID / B12 antibody / CC BY 2.0 CC BY (Ausschnitt)
Österreichische Chemiker haben ein Protein entdeckt, das im freien Flug durchs Vakuum tausendfach länger stabil bleibt als andere Eiweiße. Während gängige Proteine unter diesen Bedingungen binnen weniger Millisekunden zerfallen, zeigte das Team um Kathrin Breuker von der Universität Innsbruck, dass das Molekül mit der Bezeichnung KIX mindestens vier Sekunden seine Form behält. Die Forscher erhoffen sich nun neue Erkenntnisse darüber, durch welche Mechanismen Proteinstrukturen zu Stande kommen und stabil bleiben.
Jedes Eiweiß besteht aus einer Abfolge von Aminosäuren, doch wichtiger als diese Sequenz ist die Form, in die sich die Kette sofort nach ihrer Synthese faltet: Diese dreidimensionale Struktur bestimmt Funktion und Fähigkeit des Moleküls. In den meisten Proteinen entscheidet ein Phänomen namens hydrophober Effekt darüber, welche Grundform sie annehmen. In der wässrigen Umgebung der Zelle sortieren sich die polaren Gruppen nach außen, während sich die unpolaren Bereiche im Inneren des Proteins zusammenfinden.
Solange die Proteine im Wasser sind, kostet es viel Energie, den hydrophoben Effekt zu überwinden: Die Struktur ist stabil. Doch die tatsächlichen Anziehungskräfte zwischen den Molekülteilen selbst sind winzig, und so fällt jede Struktur binnen weniger Millisekunden auseinander, wenn sie das Wasser verlässt. Das gilt allerdings nicht für das KIX-Protein. Dieses sehr einfach aufgebaute Biomolekül besteht aus drei Helices, die sich um den üblichen hydrophoben Innenbereich lagern. Doch in diesem Fall scheinen andere Wechselwirkungen die Struktur zusammenzuhalten: Seiner Wasserhülle beraubt, bleibt KIX im Vakuum noch mindestens vier Sekunden stabil. Als Ursache machen die Wissenschaftler Salzbrücken aus. Diese Bindungen sind eine Mischung aus Wasserstoffbrücke und der elektrostatischen Anziehung zwischen positiv und negativ geladenen Aminosäuren.
Solche Strukturelemente kommen in Proteinen häufig vor, so dass sie in der Lage sein könnten, die Gesamtstruktur über so lange Zeit stabil zu halten – davon waren Forscher bisher noch nicht ausgegangen. Die ungewöhnliche Stabilität von KIX wird nicht nur zum Verständnis strukturbildender Mechanismen bei Proteinen beitragen; die Forscher wollen an dem unverwüstlichen Biomolekül auch neue massenspektrometrische Verfahren zur Proteinanalyse erproben. (lf)
Jedes Eiweiß besteht aus einer Abfolge von Aminosäuren, doch wichtiger als diese Sequenz ist die Form, in die sich die Kette sofort nach ihrer Synthese faltet: Diese dreidimensionale Struktur bestimmt Funktion und Fähigkeit des Moleküls. In den meisten Proteinen entscheidet ein Phänomen namens hydrophober Effekt darüber, welche Grundform sie annehmen. In der wässrigen Umgebung der Zelle sortieren sich die polaren Gruppen nach außen, während sich die unpolaren Bereiche im Inneren des Proteins zusammenfinden.
Solange die Proteine im Wasser sind, kostet es viel Energie, den hydrophoben Effekt zu überwinden: Die Struktur ist stabil. Doch die tatsächlichen Anziehungskräfte zwischen den Molekülteilen selbst sind winzig, und so fällt jede Struktur binnen weniger Millisekunden auseinander, wenn sie das Wasser verlässt. Das gilt allerdings nicht für das KIX-Protein. Dieses sehr einfach aufgebaute Biomolekül besteht aus drei Helices, die sich um den üblichen hydrophoben Innenbereich lagern. Doch in diesem Fall scheinen andere Wechselwirkungen die Struktur zusammenzuhalten: Seiner Wasserhülle beraubt, bleibt KIX im Vakuum noch mindestens vier Sekunden stabil. Als Ursache machen die Wissenschaftler Salzbrücken aus. Diese Bindungen sind eine Mischung aus Wasserstoffbrücke und der elektrostatischen Anziehung zwischen positiv und negativ geladenen Aminosäuren.
Solche Strukturelemente kommen in Proteinen häufig vor, so dass sie in der Lage sein könnten, die Gesamtstruktur über so lange Zeit stabil zu halten – davon waren Forscher bisher noch nicht ausgegangen. Die ungewöhnliche Stabilität von KIX wird nicht nur zum Verständnis strukturbildender Mechanismen bei Proteinen beitragen; die Forscher wollen an dem unverwüstlichen Biomolekül auch neue massenspektrometrische Verfahren zur Proteinanalyse erproben. (lf)




Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.