News: Der kleinste Energielieferant
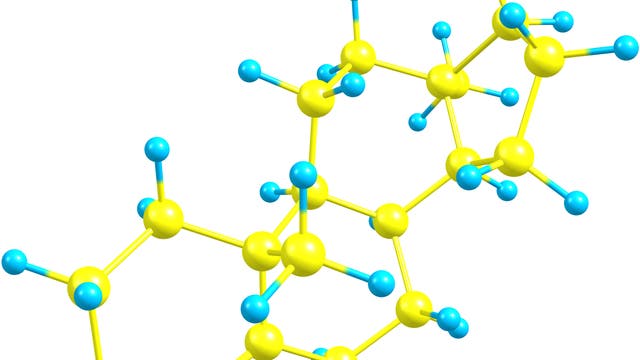
Erste Hinweise auf den eigentlichen Funktionsmechanismus der F-ATPase ergaben sich aus der 1994 aufgeklärten räumlichen Struktur des Kopfteils. Es besteht aus sechs Komponenten, von denen drei – die so genannten ß-Untereinheiten – aktiv an der ATP-Synthese beteiligt sind. Jede ß-Untereinheit enthält eine Bindungstasche, in der die eigentliche ATP-Bildung aus Adenosindiphosphat (ADP) und Phosphat stattfindet. Eine der drei Bindungstaschen ist in dieser Struktur leer, die zweite lediglich mit dem Ausgangsmolekül ADP besetzt, und die dritte enthält das eigentliche Reaktionsprodukt, das ATP. Die Moleküle in den Bindungstaschen werden also unterschiedlich stark gebunden – und das, obwohl die drei ß-Untereinheiten chemisch völlig identisch aufgebaut sind. Sie unterscheiden sich aber in ihrer räumlichen Struktur: Während die untere Hälfte der leeren ß-Untereinheit von der Achse weg nach außen geklappt ist, sind die beiden anderen, beladenen ß-Untereinheiten geschlossen.
Diese Beobachtung ließ vermuten, dass die vom Fußteil bewirkte Drehung der Achse ein wechselseitiges Öffnen und Schließen der drei ß-Untereinheiten erzwingt, in deren Bindungstaschen reihum ein ATP-Synthesezyklus stattfindet – vergleichbar den Kolbenbewegungen eines Ottomotors. Die durch die Drehung der Achse übertragene Energie dient dazu, das nach der Synthese in der Bindungstasche fest gebundene ATP-Molekül freizusetzen. Wie die rotierende Achse die Strukturänderungen in den ß-Untereinheiten auslöst, war bisher nicht bekannt. Auch wusste man nicht, auf welche Weise Energie mechanisch auf die Bindungstaschen übertragen wird, so dass dort die Bindungsstärke von ATP sinkt. Schließlich war unklar, wie die leere Untereinheit nach der Freisetzung des ATP-Moleküls wieder in ihren geschlossenen Ausgangszustand zurückkehrt.
Rainer Böckmann und Helmut Grubmüller vom Max-Planck-Institut für biophysikalische Chemie haben sich dieser offenen Fragen angenommen und es gelang ihnen mit aufwändigen Computersimulationen, die Strukturänderungen innerhalb der ATPase von der Achse bis zu den aktiven Synthesezentren im atomaren Detail zu verfolgen. Die Wissenschaftler haben dazu den Kopfteil des Enzyms im Computer Atom für Atom nachgebaut und mit Wassermolekülen und Salzionen umgeben, um auch das natürlichen Umfeld des virtuellen Proteins zu simulieren. Zuletzt umfasste das Modell etwa 200 000 Atome, deren Bewegungen in einer anschließenden "Molekulardynamik-Simulation" genau berechnet wurden. Ein aus 120 Prozessoren bestehender Hochleistungsparallelrechner der Gesellschaft für Wissenschaftliche Datenverarbeitung Göttingen benötigte dazu annähernd zwei Jahre Rechenzeit. Entstanden ist eine Filmsequenz, in der jedes Detail der Strukturänderung am Bildschirm betrachtet und analysiert werden kann.
Die Simulationen zeigen, dass sich in der ß-Untereinheit eine Reihe von Strukturänderungen wie bei einem mechanischen Hebelwerk domino-artig fortsetzen – von der Kippbewegung der unteren Hälfte der Untereinheit bis hin zu einer präzise koordinierten Verformung der Bindungstaschen-Moleküle. Eine wichtige Funktion übernehmen dort drei positiv geladene Aminosäuren (Arginine), die in genau definierter Abfolge von den negativ geladenen Phosphatgruppen des ATP-Moleküls weggezogen werden. Daurch wird die wechselseitige elektrostatische Anziehung verringert, und der "Griff" um das gebundene ATP-Molekül so gelockert, dass es die Bindungstasche verlassen kann.
In den Simulationen wird auch deutlich, dass sich die leere ß-Untereinheit nach Drehen der Achse sehr schnell – wie eine zurückschnellende Feder – schließt. Dieser Befund überraschte die Wissenschaftler, da bisher allgemein angenommen wurde, dass die leere ß-Untereinheit erst durch die erneute Bindung eines ADP-Moleküls in den geschlossenen Zustand gezwungen wird. Durch diese neue Einsicht wird die Analogie zum Ottomotor noch deutlicher: Auch dort werden die Kolben nicht erst durch das Einströmen des Benzin-Luft-Gemischs nach oben bewegt, sondern bereits vorher und synchronisiert mit der Bewegung der Kurbelwelle.
Die Forschungsergebnisse beweisen, dass dank verbesserter Simulationsverfahren und höherer Rechenleistung zunehmend erfolgreich wichtige biologische Funktionsprozesse auf atomarer Ebene simuliert werden können. Damit werden dann, über die traditionelle Bioinformatik hinausgehend, biologische Prozesse und ihre physikalisch-chemischen Gesetzmäßigkeiten veranschaulicht – beispielsweise die Funktionsweise des zellulären Ottomotors F-ATPase.
Die Max-Planck-Gesellschaft (MPG) ist eine vorwiegend von Bund und Ländern finanzierte Einrichtung der Grundlagenforschung. Sie betreibt rund achtzig Max-Planck-Institute.



Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.