Epigenetik: Vererbung via Protein
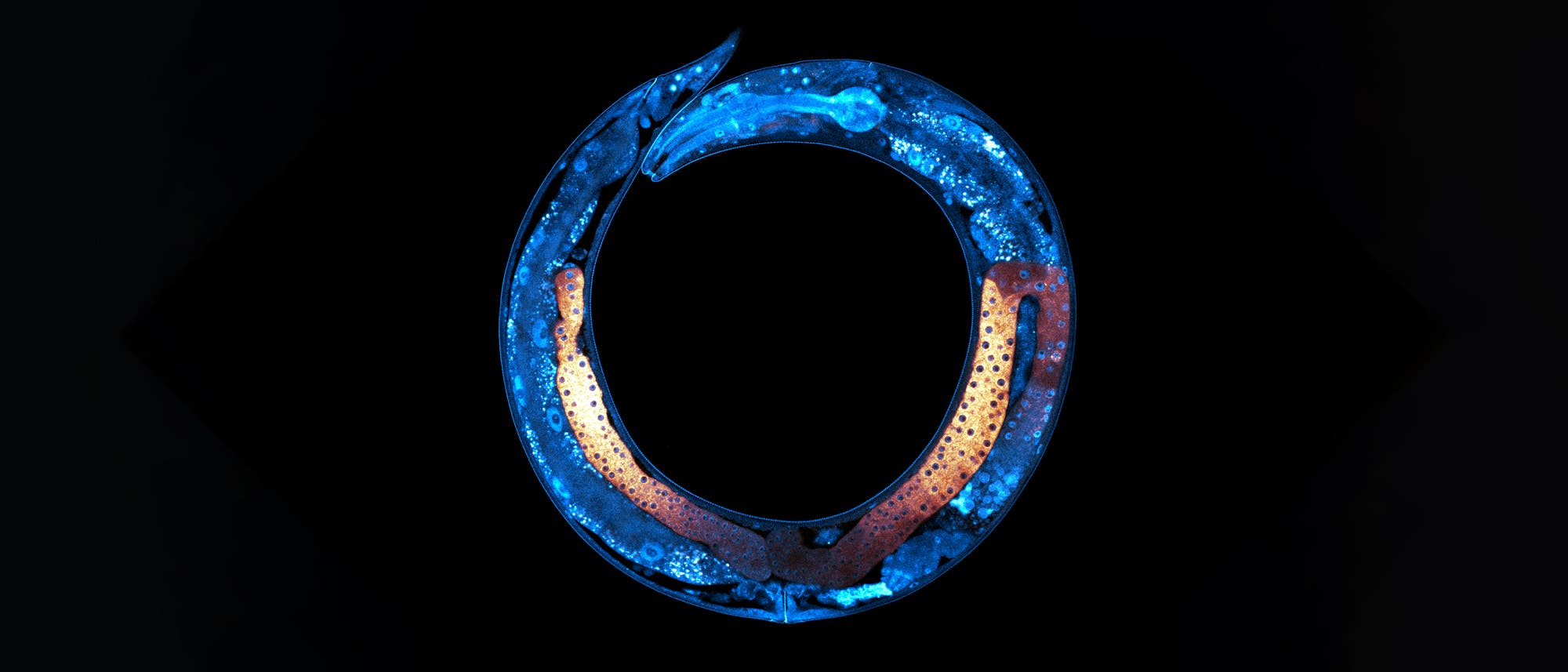
Vererbung läuft nicht ausschließlich über die DNA-Sequenz der Gene – das haben die Erkenntnisse aus der Epigenetik der letzten Jahrzehnte bereits gezeigt. So werden etwa bestimmte Informationen über chemische Anhängsel des DNA-Moleküls oder der DNA-Verpackungsproteine an die nächste Generation weitergegeben. Aber es geht sogar ganz ohne Nukleinsäuren: Ein Forschungsteam der University of Toronto hat einen rein auf Proteinen beruhenden Mechanismus der generationsübergreifenden Informationsübertragung bei Fadenwürmern entdeckt.
Untersucht wurde das Phänomen an dem rund einen Millimeter langen Fadenwurm Caenorhabditis elegans, einem beliebten Modellorganismus in der biologischen Forschung. Er besitzt eine ungewöhnliche Fortpflanzungsstrategie: Neben wenigen rein männlichen Würmern, die nur Spermien produzieren, finden sich vor allem Zwitter, die während eines kurzen Zeitraums Spermien herstellen und dann auch Eizellen bilden. Was diese vorübergehende Spermienbildung möglich macht oder wie der Übergang zur Zweigeschlechtlichkeit reguliert wird, ist bislang kaum erforscht.
Brent Derry und sein damaliger Doktorand Matthew Eroglu erzeugten mit Hilfe der CRISPR-Cas-Methode so genannte Knockout-Tiere, bei denen bestimmte Gene gezielt ausgeschaltet sind. Bei einer der genetisch veränderten Wurmlinien machten sie eine überraschende Beobachtung: Die zwittrigen Tiere, denen zwei bestimmte Gene fehlten, pflanzten sich zunächst durch Selbstbefruchtung fort. Doch mit jeder neuen Generation nahm die Selbstfruchtbarkeit der Würmer ab, und sie zeigten zunehmend weibliche Merkmale. Die Forscher tauften die beiden Gene daher mstr-1 und mstr-2, kurz für »multigenerational sterility, temperature regulated«, denn die beobachtete »Verweiblichung« scheint zudem von der Umgebungstemperatur abzuhängen.
Jede Generation wird weiblicher
Wie das Team entdeckte, sorgen die entsprechenden MSTR-Proteine normalerweise für eine ausgewogene Menge an geschlechtsbestimmenden Faktoren, so dass zwittrige Würmer sowohl Eizellen als auch Spermien bilden können. Ohne die beiden MSTR-Proteine gerät dieses Gleichgewicht offenbar mit jeder neuen Generation immer mehr aus den Fugen. »Wir waren verblüfft«, sagt Matthew Eroglu, Erstautor der Studie und mittlerweile Postdoc an der Columbia University. »Obwohl die Nachkommen genetisch identisch sind und sich durch Selbstbefruchtung fortpflanzen, nahm die Zahl der Würmer mit ›feminisiertem‹ Phänotyp von Generation zu Generation zu.« In der ersten fanden sie etwa 30 Prozent weibliche Würmer, in der nächsten bereits 70 Prozent. Wurden die Tiere bei 25 °C gehalten, erhöhte sich dieser Anteil schrittweise weiter, bis schließlich alle Nachkommen weiblich und selbst steril waren: Solche »feminisierten« Würmer können sich nicht mehr selbst befruchten, sich aber als funktionsfähige Weibchen mit einem männlichen Wurm paaren und Nachwuchs hervorbringen.
Woher stammt dieser Unterschied zwischen den Generationen trotz ihres identischen Erbguts? Der Verdacht fiel auf epigenetische Faktoren, die bekanntermaßen die Ausprägung von Genen beeinflussen und zum Teil an die nächste Generation weitergegeben werden, ohne dass die Information im Erbgut selbst verschlüsselt ist. Die Autoren vermuteten, dass hier in unterschiedlichem Maß ein veränderlicher epigenetischer Faktor vererbt wird, der bestimmt, wie sehr die Geschlechtsentwicklung in Richtung Eizellenbildung verschoben ist.
Die bisher bekannten Formen epigenetischer Informationsweitergabe (siehe »Epigenetische Vererbung bei Tieren«) beruhen auf chemisch angehängten Atomgruppen an der DNA oder den Histonproteinen, die für die Platz sparende Verpackung des DNA-Strangs als Chromatin im Zellkern sorgen. Diese Markierungen beeinflussen, welche Gene in welchem Ausmaß abgelesen oder welche Gene komplett abgeschaltet sind. Auch kleine Ribonukleinsäuremoleküle (snRNAs), die nicht in Proteine übersetzt werden und stattdessen die Aktivität anderer Gene regulieren, können über Eizelle und Spermium weitergegeben werden und so die Eigenschaften der eigenen Nachkommen beeinflussen. Kurzum: Vererbung läuft bei Tieren in der Regel direkt über Nukleinsäuren, also DNA oder RNA, oder über epigenetische Chromatinveränderungen.
Epigenetische Vererbung bei Tieren
Mittlerweile sind zahlreiche Mechanismen bekannt, die dafür sorgen, dass einzelne Gene stärker oder schwächer abgelesen werden, ohne dass dazu die Abfolge der Nukleinbasen A, T, G und C in der DNA verändert wird. Da diese Anweisungen nicht im Genom selbst codiert sind, werden sie auch als epigenetische Informationen bezeichnet. Mit ihrer Hilfe können verschiedene Körperzellen Proteine in unterschiedlicher Menge produzieren, obwohl alle über dieselbe genetische Ausstattung verfügen. Der Clou: Im Gegensatz zum Genom hängt die epigenetische Prägung von Umwelteinflüssen ab. So können Zellen flexibel auf ihre Umwelt reagieren und sich ihr anpassen. Wäre es da nicht praktisch, solche wertvollen Informationen an den eigenen Nachwuchs weiterzureichen? Tatsächlich ist es gerade bei Einzellern gang und gäbe, dass sich nützliche epigenetische Umweltanpassungen in der nächsten Generation durchsetzen und ihr so einen Evolutionsvorsprung verschaffen.
Vor allem bei Säugetieren gibt es für eine solche epigenetische Vererbung allerdings zahlreiche Hindernisse. Stabil vererbt wird überwiegend die genomische DNA beider Eltern und die mitochondriale DNA der Mutter. Andere Bestandteile der elterlichen Ei- und Spermazelle werden während der Entwicklung des Embryos nach und nach durch neues, in dessen Genom codiertes Material ersetzt. Auch epigenetische Markierungen auf dem Erbgut der Eltern werden wahrscheinlich größtenteils entfernt – einmal während der Bildung von Ei- und Samenzellen und dann noch einmal direkt nach der Befruchtung.
Obwohl sich nachweisen ließ, dass einige Tiere wie Würmer oder Insekten epigenetisch gespeicherte Umweltanpassungen stabil über ihre Keimbahn weitergeben können, ist umstritten, ob auch Säugetiere und insbesondere der Mensch zu einer echten »transgenerationalen epigenetischen Vererbung« in der Lage sind. Allerdings gelang es trotz zahlreicher Studien bisher nicht, die erbliche Komponente vieler Krankheiten, darunter Schizophrenie, Diabetes Typ II oder bestimmte Krebsarten, auf bekannte genetische oder epigenetische Mechanismen zurückzuführen. Ob eine proteinbasierte Vererbung, wie sie bei Pilzen und nun auch bei Würmern bekannt ist, dazu beitragen könnte, muss sich erst zeigen.
Eiweißstoffe mit schlechtem Ruf
Alle diese üblichen Verdächtigen konnte das Team jedoch experimentell ausschließen – und stand damit vor einem Rätsel. Bis zu dem Moment, als es die Eizellen der sterilen mstr-Knockout-Würmer mit dem Fluoreszenzmikroskop näher betrachtete. Dabei zeigten sich selbstleuchtende Strukturen, die deutlich stärker ausgeprägt waren als bei normalen Tieren (dem »Wildtyp«). Sie blieben auch in den befruchteten Embryonen erhalten und ließen sich mit Farbstoffen markieren, die sich spezifisch an so genannte Amyloid-Proteine heften. Diese Eiweißstoffe haben einen schlechten Ruf: Sie neigen zum Verklumpen und stehen im Verdacht, an verschiedenen neurodegenerativen Erkrankungen beteiligt zu sein, darunter die Alzheimerdemenz (verklumptes β-Amyloid).
Mittlerweile kennt man mehr als 40 menschliche Amyloid-Proteine. Trotz ihrer unterschiedlichen Aminosäuresequenz und räumlichen Struktur haben Amyloide eine entscheidende Gemeinsamkeit: Sie können von einem löslichen Zustand, in dem sie als Einzelmolekül im Zellinneren herumschwimmen, in einen unlöslichen, kettenförmigen Zustand übergehen. Dabei lagern sich Hunderte oder Tausende einzelner Proteine zu mikrometerlangen Eiweißfäden zusammen, den so genannten Amyloid-Fibrillen. Deren Zusammenklumpen wiederum führt zu den Amyloid-Plaques, wie sie aus der Alzheimerforschung bekannt sind.
Die Fähigkeit, unlösliche Aggregate zu bilden, kann durchaus nützlich sein
Doch nicht alle Amyloid-Proteine sind schädlich; es gibt auch zahlreiche Amyloide, die eine wichtige biologische Funktion erfüllen. Denn die Fähigkeit, unlösliche Aggregate zu bilden, kann durchaus nützlich sein. Derart lassen sich zum Beispiel Proteine und Peptidhormone speichern, die in löslicher Form für die Zelle giftig wären.
Proteinschredder in der Zelle
Matthew Eroglu und seine Mitstreiter konnten nun zeigen, dass die MSTR-Proteine die Menge an Amyloid-Fibrillen in den Fadenwürmern kontrollieren. Dies bewirken sie über deren Abbau im so genannten Proteasom: einer Art Schredder in der Zelle, der überflüssige, defekte oder schädliche Proteine gezielt zerstört. Nur mit einer konstant niedrigen Menge an Amyloid-Fibrillen in den Keimzellen können die Würmer sowohl Eizellen als auch Spermien produzieren. Fehlen die beiden MSTR-Proteine, häufen sich von Generation zu Generation mehr Amyloid-Aggregate im Zytoplasma an und die Spermienproduktion lässt nach. Ist also die schiere Menge an Amyloid für den Effekt entscheidend?
Offenbar nicht nur. Besonders aufschlussreich waren hier Experimente, in denen das Team Amyloide aus Würmern mit unterschiedlichen Geschlechtsmerkmalen isolierte und in die Keimzellen von normalen Tieren injizierte, die sich entweder zu Spermien oder Eizellen entwickeln können. Überraschenderweise wiesen die Nachkommen danach jeweils genau die Eigenschaften auf, die mit den übertragenen Amyloiden verbunden waren. So führte die Injektion von Amyloiden aus feminisierten Knockout-Würmern zu einer verringerten Selbstfruchtbarkeit in den folgenden fünf Generationen. Amyloide aus unveränderten Tieren hatten dagegen keinen Einfluss auf die Nachkommen. Es kommt also wohl auch auf die jeweilige Art des Amyloid-Proteins an, nicht nur auf die Menge.
Amyloid-Aggregate, die stabil über die Keimbahn weitergegeben werden und die Selbstfruchtbarkeit der Urenkel beeinflussen? Yury Chernoff vom Georgia Institute of Technology in Atlanta, USA, haben diese Ergebnisse gar nicht so sehr überrascht. »Bei Hefen und anderen Pilzen ist die Rolle von Amyloid-Fibrillen bei der epigenetischen Vererbung gut belegt«, sagt der Forscher, der seit Jahrzehnten die Weitergabe erworbener Merkmale in Form von Prionen, die ebenfalls zu den Amyloid-Proteinen zählen, bei Hefen untersucht. »Es hätte mich gewundert, wenn diese Art der proteinbasierten Vererbung auf Pilze beschränkt wäre.«
Kristallisationskeim für Amyloide
Bei Tieren, insbesondere bei Säugetieren, sind die Hürden für eine epigenetische Vererbung über die Keimbahn allerdings deutlich höher (siehe »Epigenetische Vererbung bei Tieren«). Eigentlich würde man erwarten, dass die Proteinaggregate der Eizelle direkt nach der Befruchtung vollständig abgebaut werden. Es zeigte sich jedoch, dass bei den Würmern die elterlichen Amyloid-Strukturen als eine Art Kristallisationskeim für das weitere Fibrillenwachstum dienen, an den sich die neu gebildeten Amyloid-Proteine des Embryos anlagern.
Eigentlich würde man erwarten, dass die Proteinaggregate der Eizelle direkt nach der Befruchtung vollständig abgebaut werden
Zahllose Fragen bleiben offen: etwa jene nach den genauen Unterschieden zwischen den Amyloid-Varianten der weiblichen Knockout-Würmer und des Wildtyps, nach den konkreten molekularen Auswirkungen der Aggregate in den Zellen – und ob der neu entdeckte Mechanismus auch bei anderen Tieren vorkommen könnte. »Natürlich sind noch viele weitere Experimente nötig, um alle Details zu klären und die von uns beobachteten Phänomene als biologisch relevanten Vererbungsmechanismus zu etablieren«, sagt Eroglu. »Aber wir hielten es für notwendig, unsere Ergebnisse so schnell wie möglich zu veröffentlichen, auch um weitere Forschungen in dieser Richtung zu ermöglichen.«
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.