Progerie: Wider junges Altern
Haarausfall, Herz-Kreislauf-Schwäche, Osteoporose – die Krankheitsliste eines 85-Jährigen? Mitnichten: Der zehnjährige Patient leidet an Progerie, die seinen Körper mit dramatischer Geschwindigkeit altern lässt. Nach erfolgreicher molekularer Spurensuche sind Forscher nun vielleicht auf eine mögliche Therapie gestoßen.
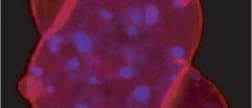
© PNAS (Ausschnitt)
Lange Zeit interessierten sich nur wenige Forscher für das Hutchinson-Gilford-Syndrom oder auch Progerie. Denn die von Jonathan Hutchinson 1886 beschriebene Krankheit ist ausgesprochen selten: Nur eines von vier Millionen geborenen Kindern wird in seinem ersten Lebensjahr plötzlich Haare verlieren, im Wachstum zurückbleiben und verzögert Zähne, dafür aber Falten bekommen. Knochenmissbildungen und Osteoporose kommen ebenso hinzu wie schwere Herz-Kreislauf-Erkrankungen, die schließlich meist um den 13. Geburtstag zum Tod führen – Kinder, die körperlich betrachtet als Greise sterben.
Im Jahr 2003 jedoch erregte das seltene Syndrom doch größeres Interesse. Denn unabhängig voneinander waren gleich zwei Arbeitsgruppen auf die molekulare Ursache der frühen Vergreisung gestoßen: Im Gen für das Protein Lamin A ist eine einzige Base gegen eine andere ausgetauscht. Dies ändert zwar nichts an der davon kodierten Aminosäure, doch entsteht auf diese Weise der Befehl, aus der abgeschriebenen Boten-RNA 150 Bausteine herauszuschneiden – weshalb die Proteinfabriken der Zelle nur das deutlich verkürzte Protein Progerin herstellen.
Und damit beginnt die Malaise: Lamin A ist eine wichtige Komponente der Kernlamina, eines Netzwerks aus Proteinen. Sie bedeckt im Kern die umhüllende Membran und sorgt nicht nur für gute Form, sondern übernimmt auch zahlreiche Aufnahmen im typischen Zellgeschehen. Um an seine Tapetenposition zu gelangen, bekommt ein Vorläufer des Lamins zunächst einen Molekülrest angehängt, mit dessen Hilfe es in der Kernmembran verankert wird. Dann wird der zusätzliche Schwanz plus ein Stück Protein wieder abgeschnitten und das Lamin freigesetzt, sodass es seinen endgültigen Bestimmungsort erreichen kann. Die Erkennungssequenz für das Enzym der zweiten Schneideaktion allerdings liegt ausgerechnet in jenem Abschnitt, der Progerin fehlt – mit dem Resultat, dass das mutierte Protein an der Kernmembran haften bleibt und dort mit weiteren Proteinen hadert. Unter dem Mikroskop zeigt sich dann ein charakteristisches Bild von Zellkernen, die aus der normalen kugeligen Verfassung geraten sind und regelrechte Bläschen und lappenförmige Beulen bilden.
Für den angehängten Molekülrest aber, eine so genannte Farnesyl-Gruppe, interessieren sich Wissenschaftler aus ganz anderem Anlass: Sie ist offenbar nötig, damit unter anderem das verbreitete Krebs-Protein Ras aktiv werden kann. Deshalb werden inzwischen verschiedene Substanzen getestet, welche das Anhängen des Molekülrests unterbinden, indem sie das dafür notwendige Enzym, die Farnesyl-Transferase, hemmen. Warum also nicht diese FTase-Inhibitoren (FTI) auch einmal bei Progerie ausprobieren?
Eine Idee, die wiederum gleich zwei Arbeitsgruppen umsetzten – beide mit Erfolg. So berichten Julia Toth von der Universität von Kalifornien in Los Angeles und ihre Mitarbeiter, dass sie mit ihrer Behandlung von Zelllinien aus betroffenen Spendern die Zahl missgestalteter Zellkerne drastisch reduzieren konnten, da sich das Progerin nicht mehr an der Kernhülle drängelte, sondern im Kern versammelte [1]. Denselben Effekt beobachteten auch Brian Capell vom Nationalen Humangenom-Forschungszentrum und seine Kollegen in ihren Experimenten [2].
Also steht ein Medikament gegen Progerie vor der Tür? Ganz so einfach ist es natürlich nicht – bei allem Optimismus betonen die Forscher, dass selbstverständlich zunächst genauer untersucht werden muss, welche Folgen das Eingreifen in das Zellgeschehen auch im Körper von Kindern mit Progerie haben wird, denn die bisherigen Experimente fanden nur an Zelllinien oder Mäusen statt. Denn auch wenn die Ergebnisse aus den bisherigen Studien zur Verträglichkeit und Nebenwirkungen von FTIs als Krebsmittel sehr positiv ausfallen, könnten sich bei den kindlichen Greisen ganz unerwartete Folgen einstellen. Und schließlich will niemand den Teufel mit dem Beelzebub austreiben.
Im Jahr 2003 jedoch erregte das seltene Syndrom doch größeres Interesse. Denn unabhängig voneinander waren gleich zwei Arbeitsgruppen auf die molekulare Ursache der frühen Vergreisung gestoßen: Im Gen für das Protein Lamin A ist eine einzige Base gegen eine andere ausgetauscht. Dies ändert zwar nichts an der davon kodierten Aminosäure, doch entsteht auf diese Weise der Befehl, aus der abgeschriebenen Boten-RNA 150 Bausteine herauszuschneiden – weshalb die Proteinfabriken der Zelle nur das deutlich verkürzte Protein Progerin herstellen.
Und damit beginnt die Malaise: Lamin A ist eine wichtige Komponente der Kernlamina, eines Netzwerks aus Proteinen. Sie bedeckt im Kern die umhüllende Membran und sorgt nicht nur für gute Form, sondern übernimmt auch zahlreiche Aufnahmen im typischen Zellgeschehen. Um an seine Tapetenposition zu gelangen, bekommt ein Vorläufer des Lamins zunächst einen Molekülrest angehängt, mit dessen Hilfe es in der Kernmembran verankert wird. Dann wird der zusätzliche Schwanz plus ein Stück Protein wieder abgeschnitten und das Lamin freigesetzt, sodass es seinen endgültigen Bestimmungsort erreichen kann. Die Erkennungssequenz für das Enzym der zweiten Schneideaktion allerdings liegt ausgerechnet in jenem Abschnitt, der Progerin fehlt – mit dem Resultat, dass das mutierte Protein an der Kernmembran haften bleibt und dort mit weiteren Proteinen hadert. Unter dem Mikroskop zeigt sich dann ein charakteristisches Bild von Zellkernen, die aus der normalen kugeligen Verfassung geraten sind und regelrechte Bläschen und lappenförmige Beulen bilden.
Für den angehängten Molekülrest aber, eine so genannte Farnesyl-Gruppe, interessieren sich Wissenschaftler aus ganz anderem Anlass: Sie ist offenbar nötig, damit unter anderem das verbreitete Krebs-Protein Ras aktiv werden kann. Deshalb werden inzwischen verschiedene Substanzen getestet, welche das Anhängen des Molekülrests unterbinden, indem sie das dafür notwendige Enzym, die Farnesyl-Transferase, hemmen. Warum also nicht diese FTase-Inhibitoren (FTI) auch einmal bei Progerie ausprobieren?
Eine Idee, die wiederum gleich zwei Arbeitsgruppen umsetzten – beide mit Erfolg. So berichten Julia Toth von der Universität von Kalifornien in Los Angeles und ihre Mitarbeiter, dass sie mit ihrer Behandlung von Zelllinien aus betroffenen Spendern die Zahl missgestalteter Zellkerne drastisch reduzieren konnten, da sich das Progerin nicht mehr an der Kernhülle drängelte, sondern im Kern versammelte [1]. Denselben Effekt beobachteten auch Brian Capell vom Nationalen Humangenom-Forschungszentrum und seine Kollegen in ihren Experimenten [2].
Also steht ein Medikament gegen Progerie vor der Tür? Ganz so einfach ist es natürlich nicht – bei allem Optimismus betonen die Forscher, dass selbstverständlich zunächst genauer untersucht werden muss, welche Folgen das Eingreifen in das Zellgeschehen auch im Körper von Kindern mit Progerie haben wird, denn die bisherigen Experimente fanden nur an Zelllinien oder Mäusen statt. Denn auch wenn die Ergebnisse aus den bisherigen Studien zur Verträglichkeit und Nebenwirkungen von FTIs als Krebsmittel sehr positiv ausfallen, könnten sich bei den kindlichen Greisen ganz unerwartete Folgen einstellen. Und schließlich will niemand den Teufel mit dem Beelzebub austreiben.




Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.