Lexikon der Biochemie: Phospholipide
Phospholipide, Membranlipide, die einen Phosphorsäurerest (Abb. 1a) in Form eines Diesters enthalten, in dem ein Alkoholteil (X in Abb. 1b) polar ist und der andere (Y in Abb. 1b) nicht polar. Der übrigbleibende dritte acide Wasserstoff des Phosphorsäurerests ist bei physiologischem pH ionisiert.
Die P. werden durch zwei Unterklassen charakterisiert:
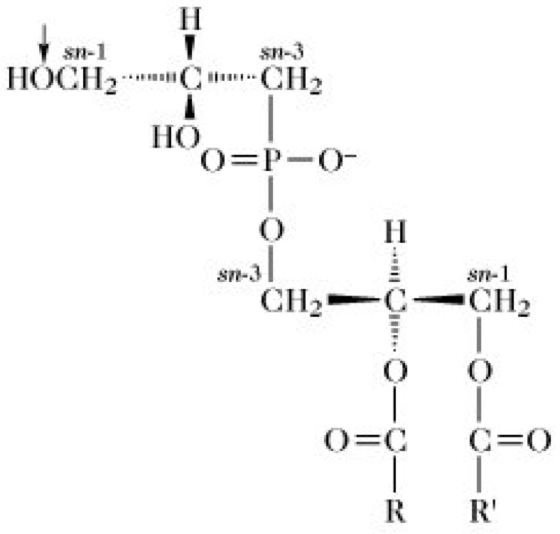
1) Glycerophospholipide (entsprechend der IUPAC-IUB-Nomenklatur), heißen auch manchmal Phosphoglyceride. Der nichtpolare Rest (Y) ist ein Glycerinderivat (Abb. 1c), z.B. 1,2-Diacyl-sn-glycerin oder 1-O-(1-Alkenyl)2-O-acyl-sn-glycerin; in beiden Fällen ist die sn-3-Hydroxylgruppe des Glycerinteils mit der Phosphorsäure verestert. Glycerophospholipide des ersten Typs (Abb. 2a) sind Derivate von L-α-Phosphatidsäure (1,2-Diacyl-sn-glycerin-3-phosphorsäure und werden auch als solche bezeichnet (z.B. Phosphatidylethanolamin), während jene des zweiten Typs (Abb. 2b) Derivate der Plasmensäure [1-O-(1-Alkenyl)-2-O-acyl-sn-glycerin-3-phosphorsäure] sind. Obwohl auch diese Verbindungen entsprechend genannt werden können (z.B. Plasmenylethanolamin), sind sie im Allgemeinen als Plasmalogene bekannt. Der Substituent in der sn-1-Position der Plasmalogene ist mit dem Glycerinkohlenstoff über eine Etherbindung und nicht über eine Esterbindung verknüpft. Aus diesem Grund werden die Plasmalogene oft den Etherlipiden zugeordnet und gemeinsam mit den Phytanylethern der Archaebakterien (Phytanylethermembranlipide) als solche klassifiziert. Die Phosphatidyl- und Plasmenylglycerophospholipid-Unterunterklassen werden in Bezug auf den polaren Alkohol, der mit ihrem Phosphorsäureteil (als Komponente X in Abb. 2a) verestert ist, weiter unterteilt. In der Tabelle sind die Strukturen dieser polaren Alkohole und die Namen der Glycerophospholipid-Unterabteilungen aufgeführt. Innerhalb jeder dieser Unterabteilungen ist jedoch eine beträchtliche Vielzahl an Molekülarten möglich, weil viele verschiedene Fettsäuren mit dem Glycerinrest der Stammstruktur verestert sein können; dies trifft auch auf alle anderen acylierten P. -Unterabteilungen zu. Die Kopfgruppen Ethanolamin- und Cholin-haltiger Glycerophospholipide sind elektrisch neutral aber polar, da jede die gleiche Anzahl ganzer positiver und negativer Ladungen besitzt, die durch Ionisation gebildet werden. Die Kopfgruppen aller anderen Glycerophospholipidarten sind elektrisch negativ geladen. Eine Reihe von Phosphatidylinositolderivaten (PI) sind auch in Biomembranen vorhanden. Beispielsweise liegen viele der in tierischen Plasmamembranen vorkommenden PI als 4-Phosphat (PIP)- und 4,5-Diphosphat (PIP2)-Derivate vor. Einige verankern Proteine auf der äußeren Oberfläche verschiedener einzelliger Eukaryonten (z.B. Trypanosoma-Arten) und Säugetierzellarten, wie Lymphocyten, mit Hilfe von ethanolaminhaltigen Oligosacchariden. Diese sind als Glycosyl-PI (GPI)-Anker bekannt.
2) Sphingophospholipide. Der nichtpolare Alkoholrest (Y) stammt von einem N-acylierten Derivat des langkettigen Aminoalkohols Sphinganin – (2R,3R)-2-Amino-1,3-octadecandiol – oder einem seiner Derivate, dem Sphingosin – trans-4-Sphingenin (2R,3R,4E)-2-Amino-4-octadecen – oder Phytosphingosin – 4-D-Hydroxysphinganin; (2S,3S,4R)-2-Amino-1,3,4-octadecantriol – ab. Diese N-Acylsphinganinderivate heißen Ceramide. Wenn die C1-Hydroxylgruppe eines Ceramids mit Phosphorsäure verestert vorliegt, resultiert eine Struktur, die der von Phosphatid- und Plasmensäuren darin ähnlich ist (Abb. 3), dass zwei Kohlenwasserstoffketten an benachbarte Kohlenstoffatome einer glycerinähnlichen Dreikohlenstoffkette gebunden sind. Ein Sphingophospholipid wird gebildet, wenn der Phosphorsäurerest eines Ceramid-1-phosphats eine zweite Esterbindung zu einem polaren Alkohol eingeht. Das bekannteste Sphingophospholipid, das in tierischen Geweben vorkommt, ist Sphingomyelin (Abb. 3), bei dem N-Acylsphingosin-1-phosphat mit Cholin verestert ist; der Fettsäureteil stammt gewöhnlich von Lignocerinsäure (C24:0) oder Nervonsäure (C24:1, cis-Δ15) ab. Die Sphingophospholipide von Pflanzenmembranen enthalten Phytosphingosin und ein komplexes Oligosaccharid als polaren Alkoholteil. Bei Letzterem ist oft myo-Inositol (Inositole) der Bestandteil, der über seine C1-Hydroxylgruppe direkt an den Phosphorsäurerest des Ceramid-1-phosphats gebunden ist.
Biosynthese. Die Phosphatidylinositole, -serine und -glycerine werden aus Phosphatidsäure gebildet. Diese reagiert mit CTP unter Bildung von 3-CDP-1,2-Diacyl-sn-glycerin, das anschließend mit Inositol, Glycerin oder Phosphatidylglycerin unter Freisetzung von CMP weiterreagiert. Phosphatidylethanolamine entstehen durch Decarboxylierung von Phosphatidylserinen, Phosphatidylcholine (Lecithine) durch Methylierung von Phosphatidylethanolaminen. Lysophosphatidsäuren (Lysolecithine und Lysocephaline) enhalten eine nichtveresterte Hydroxylgruppe. Sie werden durch die Wirkung von Phospholipase A2 (EC 3.1.1.4) und A1 (EC 3.1.1.32) aus Glycerophospholipiden gebildet. Sphingomyeline werden durch die Übertragung des passenden Phosphorylalkohols (z.B. Phosphorylcholin) aus dem korrespondierenden CDP-Alkohol auf die Ceramid-C1-Hydroxylgruppe erzeugt. Nichtsialo-Sphingoglycolipide werden durch den Transfer von Glycosylresten in der richtigen Reihenfolge aus geeignetem UDP-Zucker gebildet, anfangs auf die Ceramid-C1-Hydroxylgruppe und anschließend auf den endständigen Glycosylrest des wachsenden Oligosaccharidrests. Ganglioside stammen vom Lactosylceramid ab.
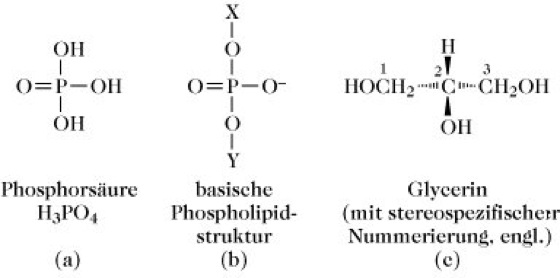
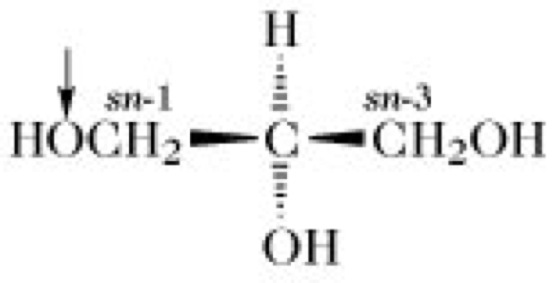
Phospholipide. Abb. 1. Struktur der Grundbausteine von Phospholipiden.
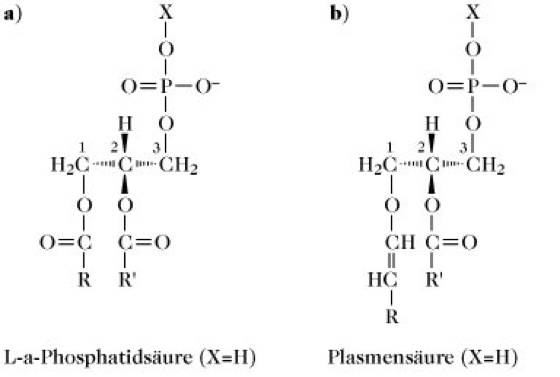
Phospholipide. Abb. 2. Grundstrukturen von a) von Phosphatidsäure abgeleiteten Phosphatidyllipiden (X ist ein polarer Alkoholrest) und b) von Plasmensäure abgeleiteten Plasmenylglycerophospholipiden (X ist ein polarer Alkoholrest). R, R' = Kohlenwasserstoffketten.
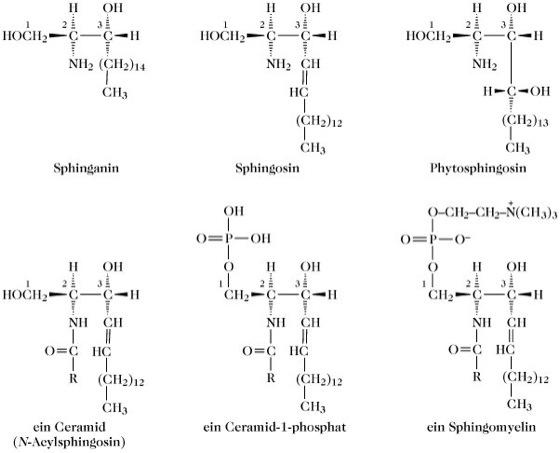
Phospholipide. Abb. 3. Struktur von Sphingomyelin- und Sphingophospholipidbausteinen. R = Kohlenwasserstoffkette.
Phospholipide. Tab. Struktur der polaren Alkohole, die mit dem Phosphorsäurerest von Glycerophospholipiden verestert sind.
Genau genommen müsste dem Namen von Phosphatidylglycerophospholipiden das Präfix (3-sn)- vorangestellt werden, um die Position des polaren Alkoholrests zu spezifizieren.
↓= dasjenige Sauerstoffatom, das esterartig mit dem Phosphorsäurerest von Phosphatidsäure bzw. Plasmensäure verknüpft ist.
R und R' = Kohlenwasserstoffketten.

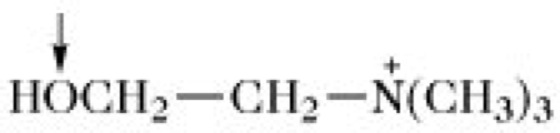









Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.